Hatásmechanizmus
A sejtfal és a peptidoglikán réteg felépítése
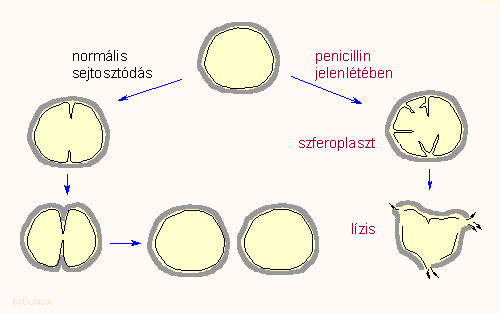
A penicillinről igen hamar kiderült, hogy valamilyen módon a baktériumok sejtfalszintézisét befolyásolja. Egyrészt, az antibiotikum csak az osztódó sejtekre hat, nyugvókra látszólag nem. Másrészt, az osztódó sejteken jellegzetes morfológiai elváltozásokat hoz létre, úgynevezett szferoplaszt képződést idéz elő amint ezt az alábbi ábra igen vázlatosan tünteti fel. Jól látható, hogy az osztódás első fázisában a befűződés abnormálisan történik, torz formák jönnek létre, ami végül a sejt líziséhez vezet. Ez arra utal, hogy a sejtfalszintézis valamelyik lépése szenved zavart, nevezetesen a fizikai merevséget biztosító peptidoglikánok létrejöttéhez szükséges transzpeptidáz és DD-karboxipeptidáz enzimek gátlódnak.
A pontosabb megértéshez nézzük meg a sejtet körbevevő réteges sejtburok (cell envilope) felépítését. A citoplazmát, a sejt belsejét a citoplazma membrán választja el a külvilágtól, ez egy kettős lipid réteg, amibe különböző fehérjék vannak beágyazva és ez a szerkezeti egység biztosítja az anyagok szelektív ki és bejutását a sejtbe. A sejtfal fizikai merevségét a térhálós szerkezetű, kerítésdróthoz hasonló biopolimer, a peptidoglikán biztosítja. Az előző fejezetekben már sokszor említett Gram-pozitív és Gram-negatív baktériumok közti különbség itt rejlik:
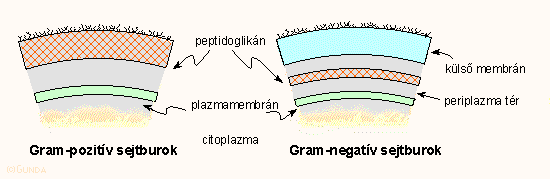
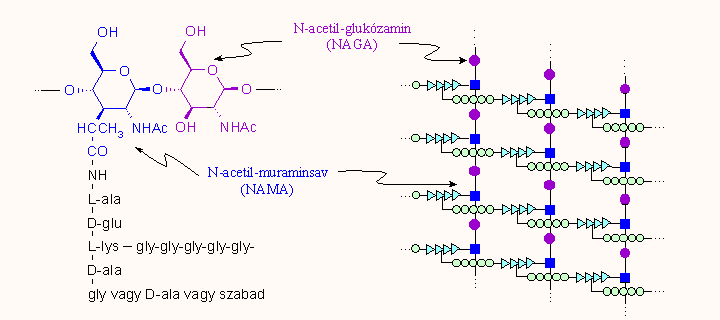
A Gram-pozitív sejtekben ez a peptidoglikán réteg vastag, a Gram-negatívokban vékonyabb, viszont ez utóbbiakban a sejtet kívűlről még körülveszi egy vastag, lipopoliszaccharidokból és foszfolipidekből álló és nehezen átjárható külső membrán (részben ez okozza a Gram-negatív baktériumok fokozott ellenállóképességét az antibiotikumokkal szemben). Legkívül helyezkedik a boholyszerű ún. glikokalix, amit O-antigénnek vagy endotoxinnak is neveznek; ez hosszabb-rövidebb szénhidrát láncokból áll s ez felelős a baktérium szerotípusáért, ez váltja ki az immunreakciót és részben a baktérium okozta toxikus, lázas tüneteket. A számunkra most érdekes peptidoglikán szerkezetét és felépülését a következő ábra mutatja. A felső részén a kész peptidoglikán van feltüntetve vázlatosan és egy eleme kémiailag részletesen is. Mint látható, a fő láncok váltakozó N-acetil-muraminsav és N-acetil-glukózamin egységekből épülnek fel. A muraminsavhoz egy rövid peptidlánc kapcsolódik, ezeket a láncokat pedig pentaglicin láncok kötik össze. Az ábra alsó részén látható az alapegység bioszintézise.

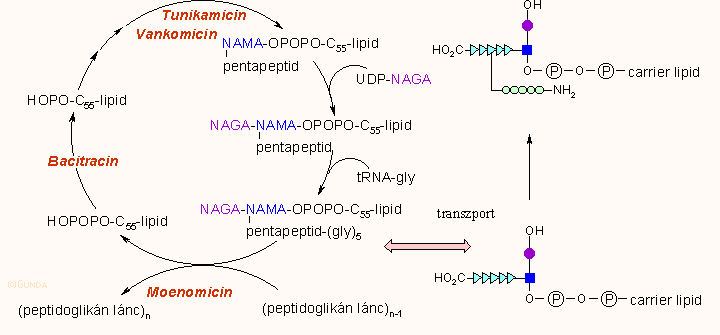
Az individuális aminosavakból és uridil-difoszfo-glukózaminből épül fel a NAGA–-NAMA–L-ala–D-glu–L-lys–D-ala–D-alaD pentapetid, amely egy lipid hordozóhoz (C55 izoprenoid alkohol) kapcsolódik. Az intracelluláris térben felépült monomer ezután az extracelluláris térbe kerül, ahol megtörténik a pentaglicin lánc hozzáadása és a végső összeszerelés. A monomer egység peptidlánca D-ala-D-ala aminosavakkal végződik. Az utolsó lépésben, a térhálós szerkezet kialakulásánál egy membránhoz kötött DD-transzpeptidáz-karboxipeptidáz enzim (ez lehet egy enzim vagy izoenzim komplex, törzsektől függően) az utolsó D-alanint átcseréli a szomszédos pentaglicin lánc utolsó glicinjére (transzpeptidáz funkció), vagy egyszerűen lehasítja az utolsó D-alanint (karboxipeptidáz funkció).
Az ábra alsó részén a tájékoztatás kedvéért feltüntettük még azoknak az egyéb antibiotikumoknak is a támadáspontjait, amelyek szintén a sejtfalszintézis gátlásával hatnak.
A penicillin hatása, hatás-szerkezet összefüggések
Penicillin jelenlétében kimutathatóan megnövekszik a peptidoglikán monomer mennyisége. A penicillin molekulát az ún. penicillin kötő proteinek (PBP) kötik meg. Ezekből azonos baktériumfajon belül is több féle van, és szerepük csak részben ismert. Van, amelyek határozott karboxipeptidáz és/vagy transzpeptidáz aktivitással rendelkezik, van olyan, amelynek valószínűleg a β-laktamáz enzim indukcióban van szerepe, van amelyikhez látszólag semmi funkció sem kapcsolódik. Az E. coliból például hét különböző PDB-t azonosítottak. Ezeket a fehérjéket a különböző β-laktamáz enzimekkel együtt penicillin-felismerő proteineknek (PRP) is nevezik, ez alatt egy olyan családot értenek, amelynél a szerinnek központi szerepe van az antibiotikummal való kölcsönhatásban. A magas molekulasúlyú peptidek (HMW-PBP) a mebránhoz kötöttek, az alacsony molekulsúlyűak (< 50 000) a periplazmikus térben vannak vagy könnyen szolubilizálhatók és ide tartozik a legtöbb β-laktamáz és karboxipeptidáz.
A penicillin hatásának kifejtése során az enzim aktív centrumában levő szerin hidroxil csoportjával reagál, s a β-laktám gyűrű felnyílása során egy penicilloil-enzim képződik, amelyből egy lassú folyamat révén regenerálódhat az enzim, s különböző penicillin bomlástermékek képződhetnek:
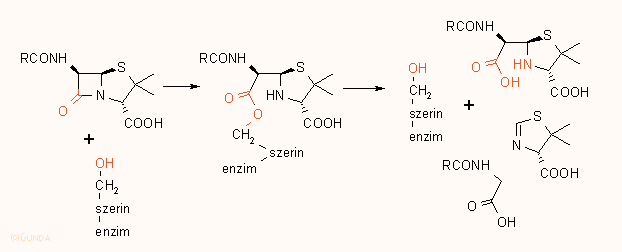
Analóg módon hatnak a kefalosporinok is. Valószínűleg a penicillinnek a peptidoglikán D-ala–-D-ala egységéhez való strukturális hasonlósága az oka, hogy az ún. penicillin kötő fehérjék (PBP), illetve az enzim elfogadják az antibiotikumot természetes szubsztrátjuk helyett: ha összehasonlítjuk a két vegyület térszerkezetét, láthatjuk, hogy a penicillin mintegy kifeszített D-ala–-D-ala-nak fogható fel:
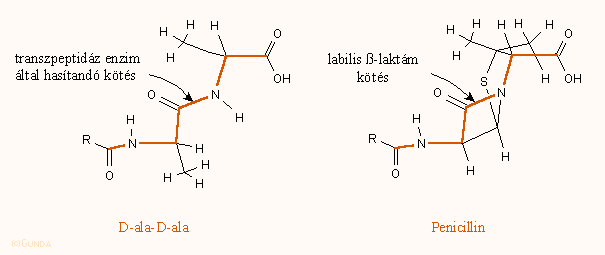
Ez az alapja a β-laktám antibiotikumok hatásmechanizmusát leíró ún. szerkezetanalóg modellnek, amelyet először még a hatvanas évek közepén Strominger és Tipper fogalmaztak meg. E szerkezetanalógiát, a jobban és gyengébben ható penicillinek konformáciájának meghatározását és illeszkedését a receptorra újabban Wolfe és mtsai vizsgálták behatóan.
Miután elég hamar kiderült, hogy a β-laktám antibiotikumok hatásáért a laktám gyűrű a felelős, természetes, hogy igen sok tanulmányban próbáltak összefüggéseket keresni az észlelt biológiai hatás és a molekulák kémiai szerkezete között. A β-laktám gyűrű amid kötésének a kémiai reaktivitása fokozott egy átlagos peptidkötéshez képest. Az egyszerű amidok OC–N kötése az ú.n. amidrezonancia miatt kissé rövidebb a szokásos OC–N egyes kötésnél, részben kettőskötés jellege van, ami spektroszkópiai úton is nyomonkövethető, másrészt az amidok nitrogénje planáris. A kefalosporinoknál még fellép egy ezzel szemben dolgozó enamin rezonancia is:
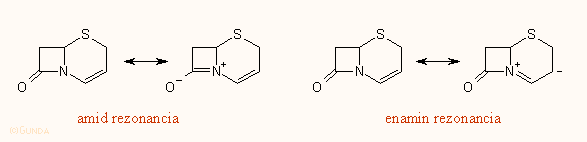
A penicillineknél a kondenzált 5-tagú, illetve a kefalosporinokban a telítetlen 6-tagú gyűrű miatt a gyűrűrendszer feszült, a nitrogén atom kissé piramidális (0.1-0.3 Å), ez az amidrezonanciát csökkenti, s növeli a β-laktám OC–N kötés reakciókészségét. Ugyancsak az amid kötés reaktivitását növeli a négytagú β-laktám gyűrű feszülése. Ezekre a hatásokra a különböző β-laktám származékok geometriai és a C=O kötés IR vegyértékrezgési adataiból lehet következtetni. A különböző adatokat az alábbi táblázat tartalmazza. A táblázatba mintegy 50 darab, a cambridge-i krisztallográfiai adatbázisból véletlenszerűen kiválasztott β-laktám vegyület koordinátáiból számolt adat van belevéve; a vegyületek az igen feszült gyűrűrendszerű penemektől a monociklikus β-laktámokig minden típust reprezentálnak. Az első oszlopban azt tüntettük fel, hogy a β-laktám gyűrű milyen másik gyűrűvel van kondenzálva.
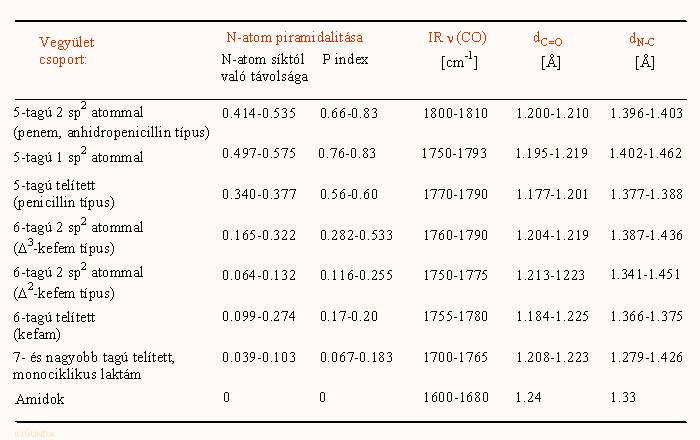
A nitrogén atom piramidalitásának (másképp nézve planaritásának) a változása a legszisztematikusabb. Ennek kétféle mértékét is feltüntettünk, a piramis h magasságát, vagyis a nitrogén atom távolságát a három szomszédos atom síkjától, és az ún. P piramidalitás indexet (ez h-val ellentétben független a kötéshosszaktól, értéke egy planáris atom esetében 0, az ammóniában 0,77). A 5-tagú telítetlen, egy vagy két sp2 szénatomot tartalmazó kondenzált rendszerekben a nitrogén atom erősen piramidális, s ez a gyűrűtagszám növekedésével vagy a telítetlenség csökkenésével egyértelműen csökken. A C-N kötéshossz a planáris rendszerekben általában rövidebb, mint pl. a penicillinekben, s az ellenkezője igaz a C=O kötésre. Ez azonban inkább csak tendencia: –a telítetlen rendszerekben az enamin rezonancia ugyanis ez ellen dolgozik. Az infravörös frekvenciák változása is nagy szórást mutat, ami nem meglepő, hiszen itt igen befolyásolnak a kísérleti körülmények (oldat vs szilárd fázisú felvétel), bár látható, hogy az erősen piramidális, rövidebb C=O kötéshosszú vegyületeknél a hullámszám magasabb, elérheti az 1800 cm-1 értéket is. Hasonló összehasonlító táblázatok több helyen is találhatók az irodalomban.
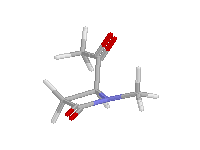
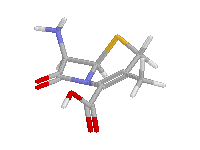
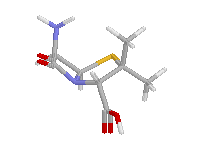
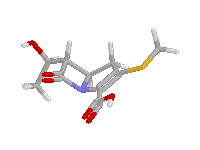
Az egyes családok β-laktám gyűrűjének piramidalitását az alábbi ábrákon szemmel is jól láthatjuk:
|
|
|
|
| Monociklikus, planáris nitrogén atom |
Kefalosporin | Penicillin | Karbapenem, piramidalitás hasonló az alkilaminokéhoz |
Mindezek arra utalnak, hogy minél nagyobb a β-laktám gyűrű nitrogén atomjának a piramidalitása, annál reaktívabb és hatékonyabb a molekula, mivel nukleofil támadásra könnyebben nyílik fel a CO-N kötés. Ez az in vitro hidrolízis adatokból is kiderül.
Az elmondottak természetesen csak az okok egy részét szolgáltatják, mivel a β-laktám gyűrű reaktivitását a penicillinek és kefalosporinok C-6(7) szubsztituense illetve az utóbbiak esetén a C-3 vagy C-3' atom szubsztitúciója is befolyásolja, amennyiben az itt levő csoport a β-laktám gyűrű hidrolízisénél eltávozik; ez elméleti megfontolások alapján szimultán folyamat is lehet:
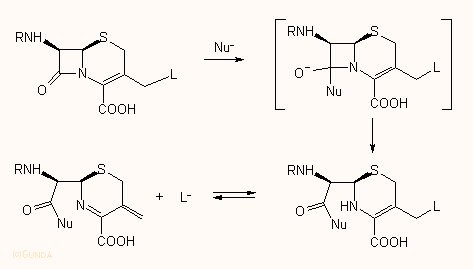
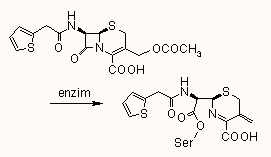 |
Röntgendiffrakciós vizsgálatokkal kimutatták, hogy a DD-karboxipeptidáz aktív centrumának szerinjéhez kapcsolódott cephalotinból csakugyan egy 3-exometilén kötést tartalmazó fragment keletkezik |  |
Az in vitro hidrolízis adatok (vagyis amikor Nu = HO–, Meo– stb) másodrendű sebességi állandói azonos sorozaton belül érthetően jól korrelálnak az egyéb fizikai-kémiai adatokkal, pl. IR frekvenciák vagy NMR eltolódások, hiszen végsősoron mindegyik a molekula elektroneloszlásával van kapcsolatban. Bizonyos esetekben azonban nem egyszerű az adatokat értelmezni, hiszen pl. a 6α-szubsztitúció hatásánál nehéz a szubsztituens induktív és térbeli gátló hatását szétválasztani A egyszerű kémiai hidrolízis adatok azonban nem vagy csak ritkán korreláltathatók jól a biológiai hatásadatokkal. Ennek természetesen az az oka, hogy a valóságban az enzimmel való kölcsönhatás során a β-laktám gyűrű reakcióképességén túlmenően legalább ugyanilyen fontos szerepe van annak, hogy a molekula a szerkezetétől függő megfelelő nemkötő kölcsönhatásba léphessen az enzimmel az E-I komplex kialakulásához, ezt pedig döntően befolyásolja az oldalláncok állása, a molekula geometriája. A két tényező egymástól elválaszthatatlan. Például a Δ1- és Δ2-karbapenemek nitrogénjének piramidalitása és a laktám kötés hidrolízisérzékenysége nagyon hasonló, azonban az előbbiek inaktívak, az utóbbi jó hatásúak. Mint az egymásra fektetett modellekből látható, a két molekula C-3 karboxi csoportjának térbeli helyzete eltérő, ami döntő lehet az enzimmel való kölcsönhatásban. Hasonló különbségek találhatók egyéb aktív és inaktív vegyületek között. Amint az ábrán látható, a penicillinek és a Δ2-kefalosporinok nagyon jól fedésbe hozhatók, ennek ellenére az utóbbiak hatástalanok, viszont a penicillinnel kevésbé jól átfedő Δ3-kefalosporinok jó hatásúak. Ennek valószínűleg az az oka, hogy a Δ2-kefalosporinoknál és a Δ1>-karbapenemeknél nem alakulhat ki az enamin rezonancia, így a β-laktám gyűrű kevésbé van aktiválva.
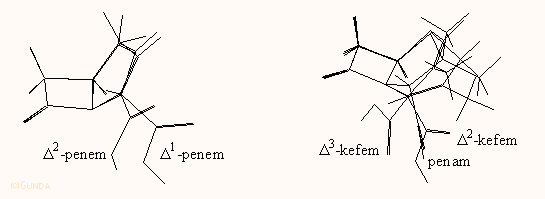
a kisérleti adatokkal való legjobb egyezést az ún. átmeneti állapot energiája mutatja (tse). a tse annak a mértéke, hogy milyen könnyen alakulhat ki a model nukleofil (általában ho–-) és egy kefalosporin molekula közti tetraéderes átmeneti komplex. számszerűleg ez a molekula plusz a "végtelen" távolságban levő ho–- ion illetve a tetraéderes komplex közötti energiakülönbség, amit különböző szemiempírikus kvantumkémiai módszerekkel lehet kiszámolni.
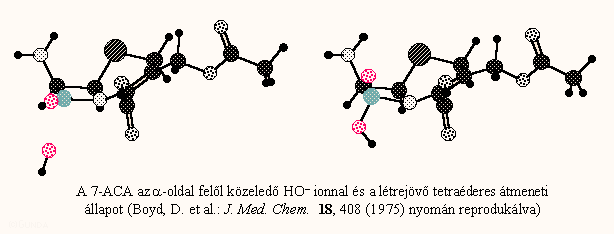
A különböző elhanyagolások miatt (pl. szolvatáció) ez nyilván nem azonos a valódi aktiválási energiával, azonban hasonló molekulák sorozatán belül arányosnak vehető vele. A következő ábrán a biológiai hatás és a β-laktám gyűrű k hidrolízis állandója illetve az átmeneti állapot energiájának összevetését láthatjuk. A függőleges tengelyen a minimális gátló koncentráció van felvéve (5 Gram-negatív törzsnél mért adatok átlaga). A molekulák C-7 amid szubsztituense azonos volt, csak 3-as szubsztituensét változtatták. Látható, hogy az in vitro hidrolízis állandó és a biológiai hatás közti összefüggés a sorozaton belül is eléggé szór. Sokkal jobb parabolikus összefüggés látszik a TSE és a biológiai hatás között. A TSE-vel kapott eredményhez hasonlóhoz lehet jutni a 3-szubsztituensek σ induktív effektusának (amennyiben a megfelelő szubsztituens állandók ismertek) felhasználásával is.
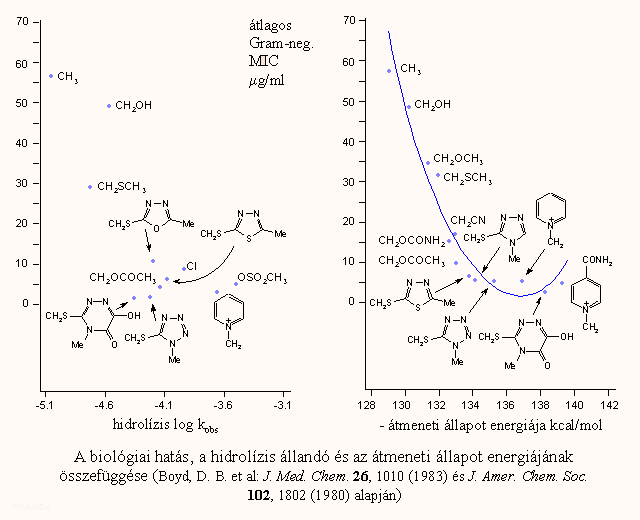
A antibakteriális hatás és a szerkezet összefüggéséről összefoglalólag az alábbiakat mondhatjuk:
- A β-laktám gyűrű aktiválása az amid rezonancia csökkentésével lehetséges. Ez elérhető a nitrogén piramidalitásának növelésével, amit elősegít a minél feszítettebb kondenzált gyűrű rendszer.
- Szintén csökkenhető az amid rezonancia az enamin rezonanciával (penemek, kefemek)
- Növeli OC-N kötés reaktivitását a β-laktám gyűrűhöz csatlakozó elektronszívó szubsztituensek (C-6(7) vagy monobaktámok N-atomja), jó elhagyó csoport jelenléte a kefem váz 3-as helyzetében.
- Az aktív β-laktám gyűrű a jó potenciális hatásnak csak az egyik feltétele, ezen túlmenően ugyanilyen fontos, hogy a molekula illeszkedjen a transzpeptidáz/karboxipeptidáz enzim aktív centrumához, amiben nagy szerepe van az oldalláncoknak, a geometriai térszerkezet, az elektronikus térszerkezet (potenciál felület), a hidrofil és hidrofób kölcsönhatások egészének.
- Végül, de egyáltalán nem utolsósorban biztosítani kell a megfelelő farmakodinamikát is; ezt szintén az oldalláncokkal lehet befolyásolni, amint erre a (fél)szintetikus származékok tárgyalásánál utaltunk.