Penemek
A penicillinből és kefalosporinből alkotott öszvér penem nukleuszt elsőként még R. B. Woodward írta le klasszikus kefem totálszintézise idején, azonban sokáig csak kuriózum maradt. A 6β-acilamido-penemek mindössze gyenge Gram-pozitív antibakteriális hatással rendelkeznek, s kémiailag sem túl stabilisak. A karbapenemek felfedezése után azonban több helyen, de leginkább talán a Farmitalia, Schering-Plough, Smith-Klein Beecham és a japán Suntory kutatói köreiben foglalkoztak velük és értek el igen bíztató eredményeket. Az antibakteriális hatásosság szempontjából gyakorlati jelentősége csak a 6α-R-hidroxi-etil oldalláncú "hibrid" származékoknak van, a megfelelő 6β-származékoknak a különböző laktamáz enzimekkel szembeni ellenállóképessége csak 1/10-1/40 a másik izomerének.
Szintézisükkel igen sok publikáció foglalkozik. A tiazolin gyűrű kialakítására hasonló módszerek alkalmasak, mint a karbapenemekére, s ugyancsak kedvelt kulcstermékek itt is a 4-acetoxi-azetidinon származékok. Az alábbi módszerek bizonyultak a legmegfelelőbbnek:
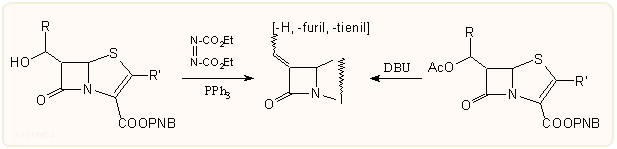
a) A legtanulmányozottabbak a Wittig reakción alapuló variánsok. Pl. az alábbi általános, azetidin-2-on-4-tritiokarbonáton keresztül haladó módszer több helyen is felbukkan, az R és az Et csoport variálásával sok származék készíthető vele (a ß-laktám 4-es helyzetében -S-R csoportot tartalmazó azetidinon származékokat igen gyakran a megfelelő O-acetil származékból lehet nukleofil cserereakcióval megkapni):
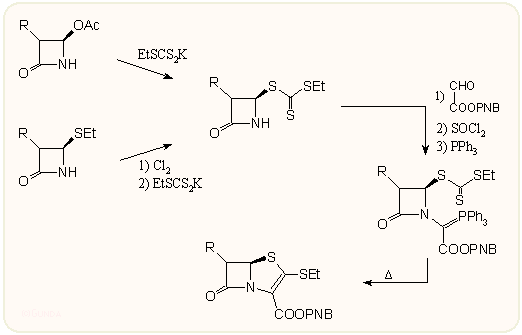
b) Valamivel későbbi keletű a módosított Wittig-Horner szintézis, amikoris nem foszforánt alkalmaznak, hanem mindkét oldalon oxo-csoportot, s a kapcsolást trimetilfoszfittal végzik, példaként álljon itt a ritipenem szintézisének megfelelő részlete:
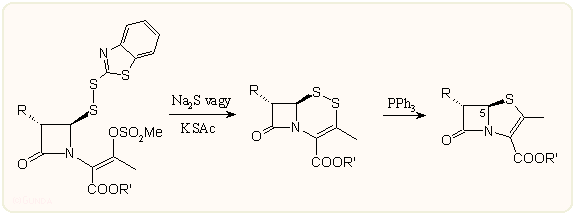
c) A 2-tiakefémen keresztül haladó deszulfuratív módszer is főleg az olasz kutatók nevéhez fűződik. A gyűrűzárás prekurzor vegyülete általában a már több helyről ismert merkapto-benzotiazol származék, az N-szubsztituens pedig mezil csoporttal van aktiválva. Ekkor kénhidrogén, kálium-tiolacetát vagy hasonló reagens hatására egy gyűrűs diszulfid származék képződik, amely megfelelő tiofil ágens, többnyire trifenilfoszfin hatására a várt penemmé alakul. A reakció gyenge pontja, hogy a kén kilépésénél a gyűrűszűkülés nem teljesen sztereospecifikus, a melléktermékként keletkező C-5 diasztereomer biológiailag inaktív:
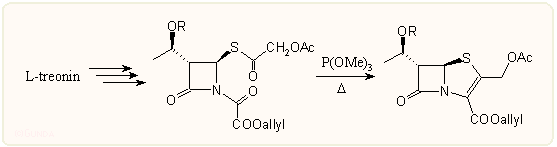
A karba- és oxapenemek gyűrűzárásánál elterjedt karbén módszer a penemeknél nem vált be: a kénhez képest β-helyzetű diazoketon elbomlásánál képződő karbén a kénatommal reagálva nem a várt gyűrűzáródás irányába halad s átrendeződéseken keresztül egyéb termékek keletkeznek. A C-3 karboxil csoport észter formátumú védésére csak rendkívül enyhe körülmények között eltávolítható csoportokat lehet alkalmazni. A karbapenemekhez hasonlóan a legkedveltebb talán az allil csoport, ami Pd° homogén katalízissel távolítható el; alkalmazható még a 4-nitrobenzil és az acetonil csoport is.
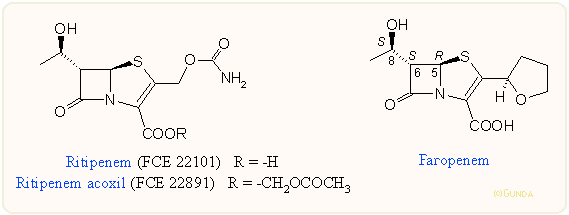
Biológiai hatás
A penemek biológiai hatása általánosságban hasonló a karbapenemekéhez, talán a Pseudomonas ellenes hatásuk gyengébb. Természetesen itt is nagyszámú vegyületet készítettek a szerkezet-hatás összefüggések feltárására. A foszforán módszerrel készített 2-aril-penemek igen jó DHP ellenállóképességükkel és farmakodinamikájukkal tünnek ki, viszont nem túl jó a Gram-negatív hatásuk. A piridil származékok hatása kedvezőbb, főleg a szubsztituálatlan 3-piridilé. Érdekes, hogy e sorozatban, ellentétben a kefalosporinokkal, a nitrogénen kvaternerizált származékok hatása több nagyságrenddel rosszabb. A Pfizer cég CP-65,207 származéka Pseudomonasok kivételével eléri az imipenem hatását. Az oldalláncban S konfigurációjú anyag in vitro 7,5-szer stabilabb DHP-val szemben, mint az R; ez a gyakorlatban emberben mintegy kétszeres vizelet koncentrációt jelent. Hasonlóak még a tetrahidrofurán/pirán származékok, nyíltláncú szulfoxidok és szulfonok. Az egyik származék a Pharmacia-Farmitalia kutatói által kifejlesztett ritipenem és aktív észter származéka. A penemek aktivitására is természetesen hat az 5-6-8 helyzet konfigurációja. A Japánban forgalmazott faropenem esetén pl. 6-R cisz izomer hatása kb. tizede az eredetinek. Érdekes módon, ezeken belül – ellentétben a karbapenemekkel – kevésbé befolyásol, hogy a 8-as helyzet R vagy S konfigurációjú-e.
A karbapenemekhez hasonlóan ugyanis, a penemek in vivo felhasználásánál is problémát okoz a renális dehidropeptidáz enzim, amely a β-laktám gyűrűt bontja, pl.:

Ha az igen jó antibakteriális hatású 6-(1-hidroxietil) származékokat Mitsunobu reakcióval dehidratáljuk, vagy az acil származékukat erős bázissal kezeljük, az így kapott asparenomicinszerű 6-alkilidén vegyületek antibakteriális hatása jóval gyengébb, viszont igen jelentős, a szulbaktáméval és klavulánsavval összemérhető a laktamáz gátló hatásuk. Az amoxicillinnel igen erős és széles sávú szinergizmust mutatnak sok β-laktamáz termelő törzzsel szemben (a Ps. aureginosát kivéve):