A gyógyszerkémia története, hatóanyagok születése 3.
Kiindulási anyag keresése
A G-penicillin és a Librium felfedezése nemcsak két új gyógyszert eredményezett, hanem két kiindulási vegyületet is, amelyek további gyógyszerek előállításához vezettek. Ha szerkezetileg új kiindulási anyagot keresünk egy adott biológiai hatás eléréséhez, az alábbi eljárások jöhetnek szóba:
-
A véletlen keresés során minden anyagot megvizsgálunk a keresett biológiai hatásra, tekintet nélkül a kémiai szerkezetre. A múlt század első felében gyakorlatilag az egyetlen módszer volt, ma már háttérbe szorult, néhány speciális esetektől eltekintve, pl. a rák vagy HIV vírus ellenes anyagok keresése során a racionális tervezés mellett ezt a lottó jellegű módszert is használják, pl. a National Cancer Institute sok százezer véletlenszerű tesztet is végez. Napjainkban a véletlenszerű keresés a kombinatorikus kémia címszó alatt más formában újra éledt, erről később részletesebben is lesz szó.
A véletlen keresés fordított formája, amikor egy új anyagot minden lehetséges hatását megvizsgálják, ezt főleg a természetből izolált anyagoknál teszik. A biodiverzitás (biológiai sokrétűség) és az ebből fakadó kémiai diverzitás még sokáig biztosítja a változatos, meglepő szerkezetű természetes anyagok utánpótlását, A tengeri élőlények alig ismertek, de a szárazföldi növények is bőven adnak még munkát – a mintegy 600.000 növényfajnak mindössze kb. 10%-át vizsgálták tudományos alapossággal, főleg a trópusi őserdők növényvilága felderítetlen még – egyes becslések szerint a potenciális gyógyszereknek mindössze egynyolcadát találták meg eddig. Más becslések szerint a lehetséges kb. 40 000 baktériumból alig 5000-et katalogizáltak eddig, a 1 500 000 gombaféléből alig 70 000 ismert. A többnyire újszerű szerkezetű anyagokat célszerű minél több tesztrendszeren átfuttatni.
-
Az irányított véletlen esetén nagyjából tudjuk, hogy milyen változtatások szükségesek vagy megengedettek. Elsősorban meglevő, ismert szerkezetek továbbfinomítását végezték így. Például a félszintetikus penicillinek nagyrésze ezzel a módszerrel, a molekula 6β-acilamido oldalláncának variálásával született. A szteroidhormonok módosításai is jórészt így születtek az elmúlt évtizedekben. Az "irányítás" természetesen annál pontosabb lehet, minél jobban ismerjük a farmakofort, vagyis a hatás kiváltásához szükséges geometriai, térszerkezeti feltételeket. Igy sok bonyolult természetből izolált hatóanyagnak készítették el az azonos vagy kedvezőbb hatású, de jóval egyszerűbb szerkezetü analógját, pl. morfin → petidin, kinin → kloroquin, tubokurarin → suxameton:
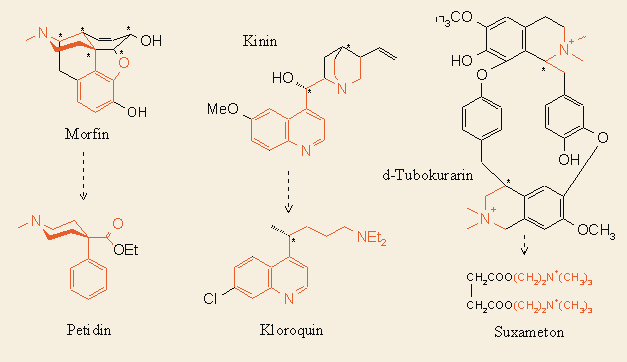
Hasonló példát sokat említhetnénk. Manapság a mind racionálisabbá váló kutatás során nem csak a kivívánt hatás maximalizálása a cél, hanem a mellékhatások csökkentése is. Egy kiváló példa erre a migrénes fejfájás kezelésére alkalmazott 5-HT (szerotonin) receptor agonisták keresése. A régen ismert természetes anyag az ergotamin nevű anyarozs alkaloid, amelynek azonban számos központi idegrendszeri (CNS) mellékhatása is van. Ennek oka, hogy kölcsönhatása nem eléggé specifikus a megfelelő alreceptorokkal. A Sandoz némileg kedvezőbb hatású egyszerűbb szerkezete (methysergid). A 90-es években két vegyület is született (sumatripan, rizartipan), amelyek már csak a az 5-HT/1B és 1D receptorokra hatnak, sokkal kevesebb mellékhatást okozva:
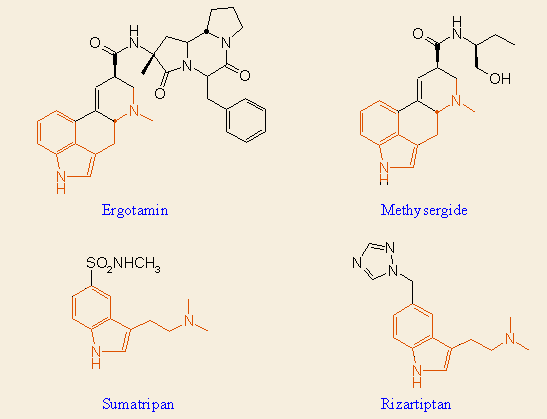
Az évek során a véletlen és irányított véletlen keresés különböző kombinációival óriási mennyiségű vegyületet teszteltek, főleg az éppen "forró" területeken; ez vezetett a racionális gyógyszerkutatás igényéhez, amint azt később részletesen is tárgyaljuk.
- Metabolitok vizsgálata
Egy gyógyszer metabolizmusa, vagyis in vivo lebomlása során keletkező anyagok vizsgálata választ adhat arra, hogy az igazi hatóanyag a gyógyszer(jelölt)-e, vagy az abból keletkező metabolit. Ennek a közelítésnek a klasszikus példája a szulfonamidok felfedezése: az 1930-as évek elején Domagk és mtsai által megvizsgált azofesték, a prontosil rubrum volt az első baktériumellenes szulfonamid. Kiderült, hogy ennek redukált metabolitja, a p-aminobenzolszulfonsav amid (szulfanilamid) az igazi hatóanyag. Ennek szubsztitúciója vezetett aztán el a ma használt szulfonamidokhoz (tudománytörténeti pletyka, hogy állítólag már Domagkék is tudták, hogy a szulfanilamid az igazi, azonban a konkurrencia megtévesztésére hozták forgalomba a prontosilt – az 1930-as években még nem tudták 2-3 nap alatt felderíteni egy ilyen egyszerű vegyület szerkezetét és rövid idő alatt elvégezni a biológiai és metabolizmus vizsgálatokat).
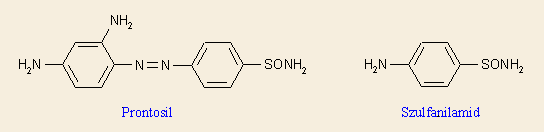
-
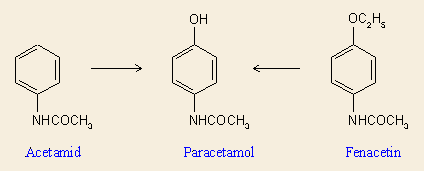
Egy másik példa az antipiretikus és analgetikus (hőcsökkentő és fájdalomcsillapitó) hatású anilinszármazékok köréből való. Az acetanilid 1886 óta ismert gyógyszerként, ma már nem alkalmazzák, mert mint anilinszármazék, erős vérméreg (methemoglobin képződés). A p-etoxi származék, a fenacetin ilyetén hatása már jóval gyengébb, azonban ez gasztrointesztinális panaszokat, májkárosodást okozhat. A hatékony metabolit mindkét esetben a májban keletkező p-hidroxi-acetamid (paracetamol). Egyébként a paracetamol sem teljesen ártalmatlan, ezért több országban kivonták a forgalomból.
A racionális gyógyszerkutatás igénye
Mint már említettük, napjainkban a piacon levő gyógyszerek legnagyobb részét igen nagy számú természetes vagy szintetikus anyag tesztelésével, vagy véletlen megfigyeléssel találták. Egy már ismert hatásos anyagból (lead – vezérvegyület vagy irányvegyület) kiindulva pedig az ún. trial-and-error finomítással megnövelhetjük a hatást, vagy csökkenthetjük a toxicitást, a nem kívánt mellékhatásokat. A tradicionális gyógyszerkutatást összességében a nagymennyiségű anyag egyenkénti költséges szintézise és ezek kimerítő, lassú manuális in vitro és in vivo tesztelése jellemzi.
Közismert, hogy egy gyógyszer kifejlesztése a kémiai ipar talán egyik legnagyobb gazdasági lidércnyomása. Egy vegyület előállítási költségére sokféle becslés született, azonban a 8000–10000 $-os adat jó átlagnak tekinthető. A klasszikus módszereket alkalmazva, 9000–10000 vegyületből egy jut el a patikába, s ez több száz millió dollárba is belekerülhet, vagy akár többe is a ma megkövetelt igen sok és időigényes vizsgálat miatt. Mig a 60-as évek elején 2,5–5 évbe került egy gyógyszer piacra vitele, ez ma már 9–13 évig is eltarthat. Az óriási erőfeszítésnek több kényszerítő körülménye is van. Egyre élesedik a verseny, többek között a folyton változó szabadalmi feltételek miatt, valamint a mellékhatások mind szigorúbb megitélése miatt is: a gyártóknak egyre inkább szükséges az új, eredeti termékek forgalmazása, másrészt a fejlesztéssel szemben magasabbak a követelmények: nem elég a kívánt hatás maximálása, a mellékhatásokat mindinkább minimalizálni kell – molekuláris szinten szelektívebb gyógyszereket kell készíteni. Becslések szerint eddig több mint 20 000 potenciális szulfonamid, 40 000 TBC ellenes szer, 120 000 malária ellenes anyag, 300 000 schistosomicid és 900 000 antineoplasztikum (rákellenes szer) került tesztelésre. A ráfordításigényesség növekedésére utal az is, hogy míg az utóbbi évtizedekben az új gyógyszerek kb 90%-a az iparban, 10%-a egyetemeken, akadémiai intézményekben született, addig korábban kb. 50%-ot fejlesztettek egyetemi kutatóhelyeken.
A növekvő követelményeket csak a mind racionálisabb gyógyszertervezés elégítheti ki – az ez iránti igény egyébként végigvonul a szerveskémia történetén Paul Ehrlich analógiaszemléletétől kezdve a mai receptorelméletekig; ma már sok hatóanyag receptorát ismerjük molekuláris szinten. A racionális gyógyszertervezéshez vezető út természetesen elég hosszú volt, s az egyszerű oldékonysági, megoszlási viszonyok elemzésével kezdődött, ebből fejlődött ki az 1960-as évek végére a Hansch analízis, amely különböző fizikai–kémiai paraméterek és a szerkezet közti hatást kereste. Ezek általában matematikai statisztikai módszerek voltak. A különböző kémiai származékok hatástani vizsgálatával pedig a receptort (farmakofort) igyekeztek feltérképezni. A számítástechnika fejlődésével a 60-as évek közepétől lehetővé váltak a molekulamechanikai és az első egyszerűbb kvantumkémiai számítások is, amivel a molekulák térszerkezetét és elektroneloszlását stb lehetett pontosabban kiszámolni. A számítástechnika rohamos fejlődésével ezek a számítások is egyre precízebbek lettek, a 80-as évek közepén megjelent a molekulagrafika és 3D szerkezet-hatás elemzés lehetősége is. A gyakorlatban két fő módszer létezik: az egyik esetben, amikor a receptor fehérje, enzim szerkezete nem ismert, aktív és inaktív molekulák segítségével térképezik fel, tapogatják le a receptort és az így nyert adatok segítségével alkotnak új molekulákat. A másik esetben, amikor pontosan ismert a receptornak vagy magának a hatóanyag–receptor fehérje komplexnek a szerkezete, a fellépő és számolható kölcsönhatásokat új vegyületekre is alkalmazzák, s ekként keresnek új hatásos vegyületeket, illetve zárnak ki eleve reményteleneket.

Nagyáteresztőképességű hatásvizsgálathoz
használt robotberendezés
(Kép: Wikipedia Commons)
Napjainkra igen megnőtt az automatikus tesztelés áteresztő kapacitása (high-throughput screening). A tiszta receptor vagy enzim fehérjék génmanipulációs technikával nagy mennyiségben állíthatók elő s igen kis mennyiségű anyagokkal, automatizált robottechnikával naponta akár több tízezres tételben vizsgáható egy anyag hatása sok enzimen, vagy sok százezer anyag egy bizonyos enzimen, receptoron. Ezt az anyagigényt nem lehet a klasszikus kémiai szintézismódszerekkel kielégíteni. Ezért új felállásban ismét előtérbe került a klasszikus, nagy számokon alapuló hatóanyag keresés: a kombinatorikus kémiai módszerekkel egyszerre lehet nagyszámú anyagot készíteni, ú.n. kémiai könyvtárakat, akár anyagkeverékeket is, így az automatikus teszteléssel nagyon nagyszámú és sokféle anyagnak vizsgálható egy bizonyos receptorfehérjével, enzimmel való kölcsönhatása. Mindezekről később részletesebben is lesz szó.
A gyógyszerkémia története iránt érdeklődőknek ajánlhatjuk Kempler Kurt: A gyógyszerek története c. könyvét (Gondolat, Budapest, 1984 2. kiad.)