Fizikai-kémiai tényezők és hatás 1.
Tekintsük át előszőr vázlatosan a gyógyszerek útját a szervezetben, majd bővebben is nézzük meg, hogy ez milyen fizikai-kémiai jelenségekkel van kapcsolatban, egyúttal néhány gyakorlati példával megvilágítva.
A gyógyszerek útja a szervezetben
Alább vázlatosan láthatjuk a fontosabb momentumait annak, hogy miként is jut el egy hatóanyag a támadásponthoz:
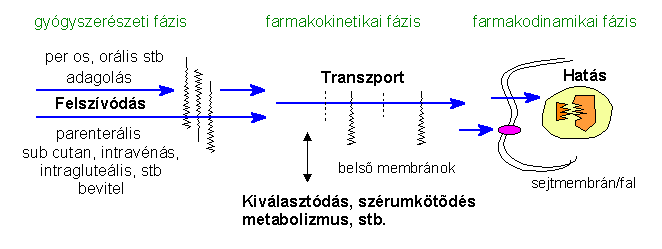
1) Felszívódás
A hatóanyagoknak, amennyiben nem a lokális hatás a cél, az első lépésben be kell jutniuk a szervezetbe, a keringésbe. Ezt három fő tényező határozza meg:
- a biológiai membránok tulajdonságaia
- a hatóanyag fizikokémiai tulajdonságai
- a hatóanyag adminisztrációjának (bejuttatásának) módja
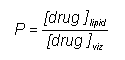
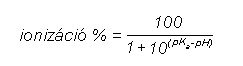
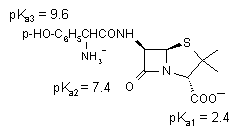
Az anyagnak egy vagy több lipidbarrieren kell keresztüljutniuk (nyálkahártya, gyomor-bél traktus, bőr). Ezek a membránok nagy lipidtartalmúak és hidrofób tulajdonságúak. A felszívódást döntően meghatározó tényező a vegyület lipidoldékonysága. Ez semleges molekuláknál eléggé parallel a víz és szerves oldószerek (pl. oktanol) közötti megoszlási hányadossal. A gyógyszerek nagyrésze azonban szerves sav vagy bázis, vagy amfoter tulajdonságú, a molekula lipofilitása (és oldékonysága) így függ az ionizációtól, a környezet pH értékétől és a molekula pK-jától. Miként a mellékelt egyenletből is látszik, egy adott pKa-jú szerves sav ionizációja éppen 50%, ha pH = pKa, de 9.1% ill 90.1% eggyel kisebb ill. nagyobb pH esetén. A megoszlási hányados értéke így ionos vegyületeknél függ az aktuális pH-tól. Ráadásul a szerves molekulák sokszor több ionizálható csoportot is tartalmazhatnak, ami tovább bonyolítja a helyzetet, pl. az amoxicillin esetén egy sav, egy primer amin és egy savanyú fenolos hidroxil csoport van a molekulában, mind különböző pK értékkel. Ebből is láthatjuk, hogy a megfelelő kiszerelés, formulázás megtalálása sokszor nem könnyű gyógyszerészi feladat, és az eredmény nagyban függ a felhasznált segédanyagoktól is. Például egész más a követelmény az ismert Germicid kúp és egy hüvelykúp esetén: az első esetben a lázcsillapító hatású amidazofent be kell juttatni a szervezetbe a rektális nyálkahártyán keresztül és a minél gyorsabb, tökéletesebb felszívódás a cél, míg a második esetben valamilyen fertőtlenítő, gomba vagy baktériumellenes szer magas lokális koncentrációjának a biztosítása a cél. Hosszú, nyújtott hatás érhető el rosszul oldódó sók parenterális beadásával (depo injekciók, pl. penicillin prokain sója, inzulin cink protamin sója), vagy újabban a bőr alá ültethető implantátumokkal, amelyből igen lassan, hónapok alatt diffundál ki a hatóanyag (pl. fogamzásgátlás).
A gyógyszerek egy része egyáltalán nem szívódik fel a gasztrointesztinális traktusból (gyomor-bél rendszer), ekkor a parenterális adagolás a lehetséges megoldás, tehát injekcióval kell a megfelelő helyre eljuttani. Természetesen ha sürgős esetben az igen gyors hatás a cél, akkor bármilyen hatóanyag esetén a parenterális adagolás a megoldás.
Manapság gyakran alkalmazzák az ún. prodrugokat. Ezek egy aktív hatóanyag olyan kémiai változatai, amelyek bár biológiailag nem aktívak, de jók a felszívódási és farmakokinetikai tulajdonságaik. A szervezetbe bekerülve aztán kémiailag spontán vagy valamilyen enzim hatására az aktív vegyületté alakulnak. Például az alábbi ábrán a β-laktám antibiotikumok körébe tartozó G-penicillin acetoxi-metil-észtert (Maripen®) láthatjuk: ez az acetoxi-metil-észter igen jól és gyorsan felszívódik a béltraktusból, majd a plazmához kötődve aspecifikus észterázok hatására az aktív szabad sav felszabadul. Ezáltal nagyobb a szérumkoncentráció felezési értéke, ritkábban kell szedni a gyógyszert. A prodrugokról itt több részlet is megtudható.
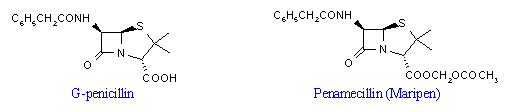 2) Transzport
2) Transzport
A prodrogok tárgyalásával már tulajdonképpen a belső transzportot is érintettük. A hatóanyagokat a belső keringés juttatja el a szervezet minden pontjába, azonban ennek során is belső membránokon kell az anyagnak átjutnia. Ilyen pl az vér-agy gát vagy a placenta, amelyeken kifejezetten nehezen jutnak át az oda nem való anyagok, hiszen éppen az erős védelem a feladatuk, de említhetjük a belső fület, a liquort, szemgolyót, emlőt stb. A szükséges anyagok átjutásáról viszont aktív transzport gondoskodik. A szervezet persze csak a saját ill. az evolúció során megismert természetbeni idegen anyagokra dolgozta ki a védelmi rendszerét, ezért a szempontjából újnak számító gyógyszerek sok meglepő, hasznos vagy éppen káros mellékhatást produkálhatnak e téren. Például a sztreptomicin (és a dihidrosztreptomicin) ototoxikus hatású, a nervus acusticust (hallóideg) károsítja, s ezért a sztreptomicin, amelynek egyébként átütő szerepe volt a TBC ellenes harcban, használatának korai fázisában, az 50-es években igen sok embernél okozott végleges halláskárosodást, sőt süketséget is. A probléma gyökere ott van, hogy a sztreptomicin bejut ugyan a belső fülbe, azonban nem tud kijutni, így koncentrációja ott jóval magasabb értéket ér el, mint a környező szövetekben.
Egy adott gyógyszer eloszlását a szervezetben egyébként egésztest-autoradiogrammal lehet megállapítani: az izotóppal jelzett anyagot beadása után a kisérleti állatból hirtelen lefagyasztás után egésztest metszetet készítenek, s ezt röntgenfilmre fektetve, exponálódás és előhívás után jól látható az anyag eloszlása a szervekben.
A közvetlen intravénás injekció kivételével a szervezetbe juttatott hatóanyag koncentrációja először emelkedik a vérben, majd a maximum elérése után csökkenni kezd. Az elimináció két legfontosabb oka a metabolizmus, az anyag lebontása, valamint a kiválasztódás.
A metabolizmus, a bevitt gyógyszer biotranszformációja szinte külön tudományterületnek tekinthető és nagyon fontos lehet a hatás megértése, a mellékhatások elkerülése miatt. A mikroszomális oxidáció, redukció, hidroxilálás, O és N-dealkilálás, aminoxidáció, hidrolízis, kémiai szubsztituálás (konjugáció), hogy csak néhány átalakulást említsünk, az új anyagok egész sorát állítja in vivo elő, amelyek mind rendelkezhetnek saját hatással is. Nem véletlen tehát manapság az a rendkívűl aprólékos, hosszadalmas (és így igen drága) vizsgálatsorozat, ami az anyag teljes szervezetbeli sorsának felderítéséhez szükséges, és így a hatóanyag mint gyógyszer zöld utat kapjon az engedélyező hatóságoktól. A ma uralkodó szigorúságot megvilágítandó tegyük még hozzá, hogy nemcsak a hatóanyag sorsát kell tisztázni, hanem a gyártás során elkerülhetetlen kisérő melléktermékekét is: ha egy anyag 99%-os tisztaságú, akkor az egy százalékot kitevő esetleg 2-3 egyéb komponens (pl. optikai izomerek) útját is végig kell követni.
A gyógyszerek legnagyobb részét a vese választja ki, másodsorban az epe a legjelentősebb, de kiválaszthatják az anyagot a verejtékmirigyek vagy az emlőmirigyek is stb. A kiválasztás helyén az anyag igen magas, akár toxikus helyi koncentrációt is elérhet. Például higanyvegyületek akkor is véglegesen tönkretehetik a vesetubulusokat, ha a szervezetben való összmennyiségük nem éri el egy veszélyes akut mérgezés szintjét. 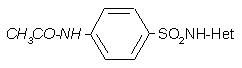 A metabolizmussal összefüggésben is kialakulhatnak mellékhatások: például az antibakteriális hatású szulfonamidok a metabolizmusuk során részben acetileződnek a májban. Az acetilezett származék sokkal rosszabbul oldódik vízben, mint az anyavegyület, ezért a vesecsatornákban kikristályosodhat, ezzel fizikai károsodást és kőképződést indítva meg. A későbbi szulfonamidoknál már vigyáztak, hogy az acetilszármazék is jól oldódjon vízben. Maguk a szulfonamidok is kikristályosodhatnak a vesecsatornákban, ha a kb. 6-os pH-jú vizeletben rosszul oldódnak.
A metabolizmussal összefüggésben is kialakulhatnak mellékhatások: például az antibakteriális hatású szulfonamidok a metabolizmusuk során részben acetileződnek a májban. Az acetilezett származék sokkal rosszabbul oldódik vízben, mint az anyavegyület, ezért a vesecsatornákban kikristályosodhat, ezzel fizikai károsodást és kőképződést indítva meg. A későbbi szulfonamidoknál már vigyáztak, hogy az acetilszármazék is jól oldódjon vízben. Maguk a szulfonamidok is kikristályosodhatnak a vesecsatornákban, ha a kb. 6-os pH-jú vizeletben rosszul oldódnak.
A legfontosabb pont természetesen a farmakodinamikai fázis, a gyógyszer kölcsönhatása a receptorral és a hatás kifejtése. Az általános érzéstelenítők (altatószerek) kivételével szinte minden gyógyszernek van egy specifikus támadáspontja, receptora. A támadáspont lehet magában a sejtben is (pl. egy bizonyos enzim gátlása), de a receptor nagyon gyakran a sejtmebránon van, pontosabban abba beágyazva: a hatóanyag (ligandum) miután kötődött a külső oldalon, a belső oldalon egy kémiai eseménysorozatot, biológia választ indít el. A későbbiekben ezzel bőven foglalkozunk.