Karbapenemek 1.
Karbapenemek felfedezése, izolálása, természetes származékok
Az 1977-79-es években az angol Beecham cég kutatói egy többkomponensű, mind antibiotikus, mind β-laktamáz gátló hatással rendelkező elegyet izoláltak a Streptomyces olivaceusból (Brown és munkatársai), amelyet a további vizsgálatok során egyre több összetevőre tudtak szétválasztani, s az MM-számjelzést kapták, illetve összefoglalóan olivánsavaknak nevezték őket. Ezzel párhuzamosan a Merck cég kutatói (Albers-Schönberg, Kahan és munkatársai) a Streptomyces cattleyából izolálták a tienamicint, eredetileg egy peptidoglikán szintézist gátló anyagokat kereső program során.

A tienamicin együtt termelődik az N-acetil származékkal, N-penicillinnel és C-kefamicinnel. A tienamicin igen kedvező antibakteriális spektrummal rendelkezett, erős Gram-pozitív hatás mellett lefedte a Gram-negatív baktériumok nagy részét, beleértve a Pseudomonas aeruginosát is. A további vizsgálatok során a család újabb tagjaira bukkantak, az epitienamicinekre, amelyek nagy része azonosnak bizonyult a Beecham-féle olivánsavakkal. Az új antibiotikumcsalád a karbapenem összefoglaló nevet kapta.
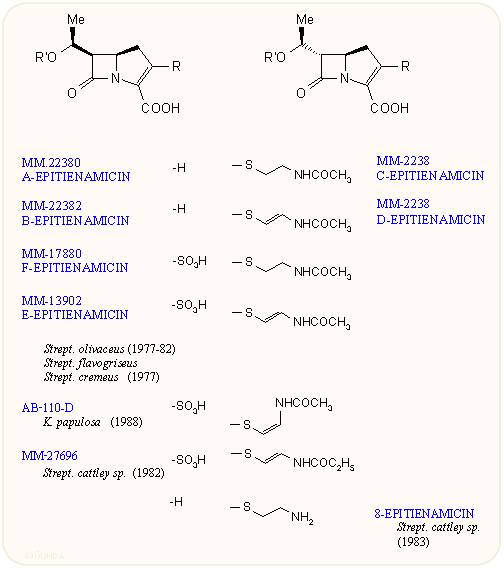
A vegyületcsoport első tagjainak felfedezése lavina módjára indította a további kutatásokat. A japán Sanraku-Ocean kutatói találtak rá a PS családra, amely a C-8 atomon nem tartalmaz hidroxi csoportot A Shionogi kutatói nevéhez fűződik az asparenomicin család, amelyben a kén atom oxidált, valamint a C-6 szubsztituens is telítetlen. A karpetimicinek C-3 oldalláncában szintén szulfoxid van (Takeda ill. Tokyo Research Co.). A pluracidomicineket a Shionogi, a panteteinil oldalláncú OA családot a Sanraku-Ocean kutatói írták le, sőt baktériumokban megtalálták a karbapenem alapvázat és néhány karbapenamot is. A 80-as évek első felének dömpingje után egy-egy minor komponenst még később is találnak, így az eddig leírt természetes karbapenemek száma negyven fölé emelkedett:
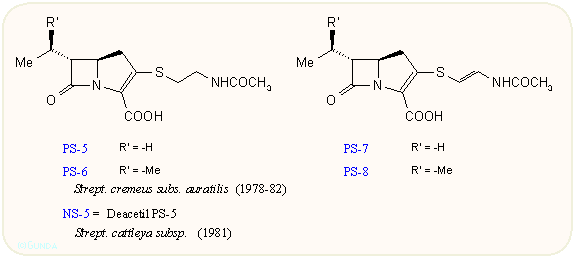
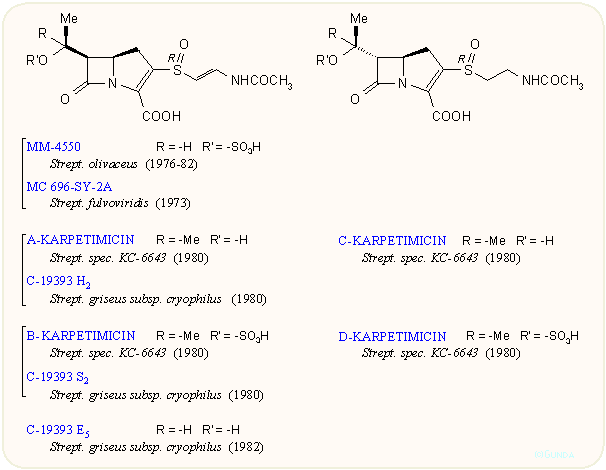
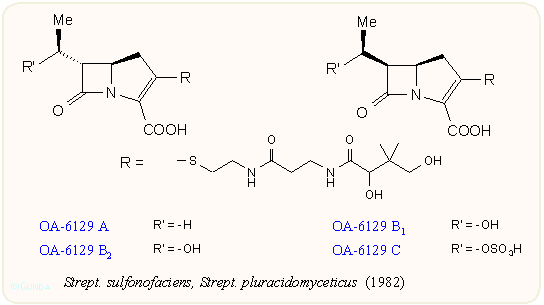
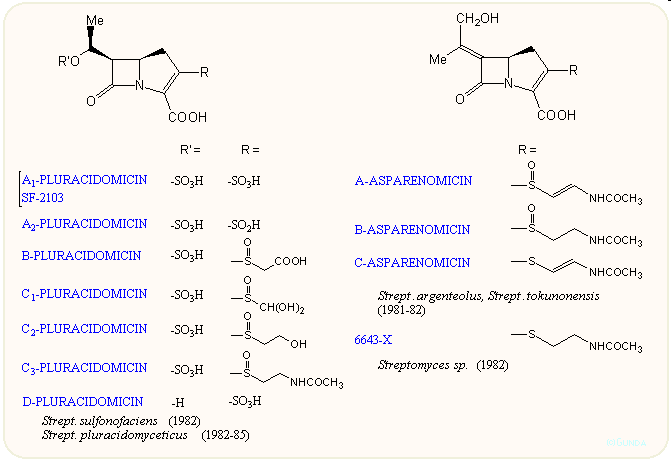
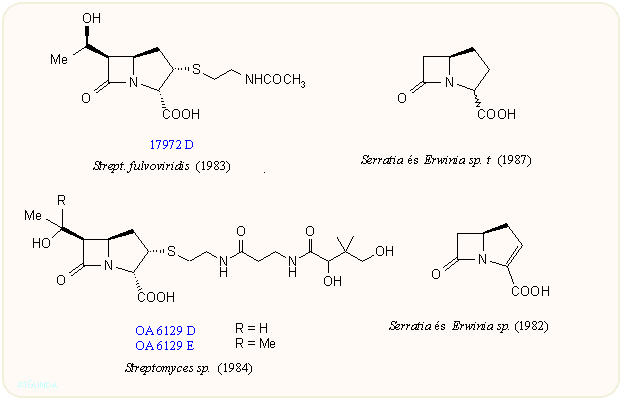
Mint látható, a karbapenemek szerkezete a penicillinek és kefalosporinok között van, az öt tagú gyűrű kén atomot nem tartalmaz, viszont kettős kötést igen; ez utóbbira jellemző a 300 nm körüli UV elnyelés. A C-3-as helyzetben β-aminoetiltio oldalláncot tartalmaznak, ez lehet telített vagy telítetlen, acetilezett vagy szabad NH2 csoportot tartalmazó. A C-6 helyzetben hidroxietil csoport van; a hidroxi csoport lehet szabad vagy szulfát észter, ez utóbbiak mennyiségét befolyásolni lehet a táptalaj szervetlen szulfát tartalmával. A β-laktám gyűrű cisz vagy transz helyzetű lehet, az annelációs szén mindig R, a másik kettő (C-5 és C-8) R vagy S lehet. A β-laktám gyűrű cisz/transz konfigurációja leginkább 1H-NMR alapon dönthető el, J5,6 = 6 ill. 3 Hz. A táblázatokból látható, hogy a természetből szinte mindegyik kombinációt izolálták.
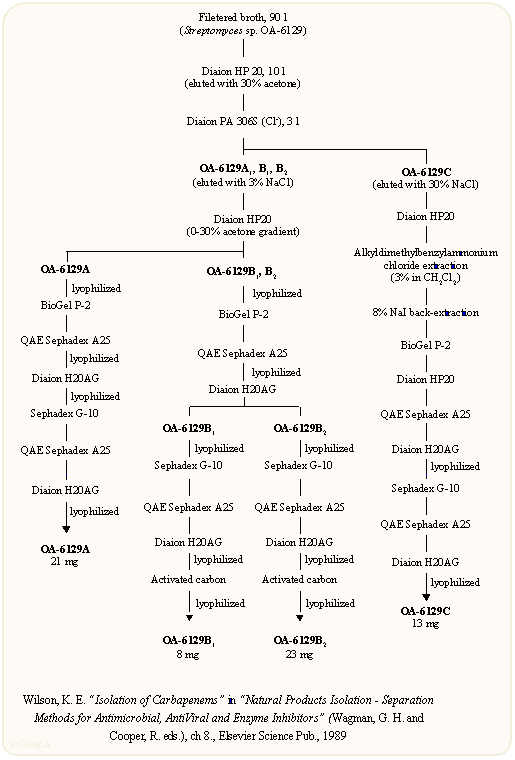
A karbapenem gyűrűrendszer igen feszült és kémiailag labilis, a vegyületek csak egy szűk pH tartományban stabilisak, ezért az izolálásuk bonyolult, gélszűrést, ioncserélő kromatográfiát, valamint a szulfátészter származékoknál ionpár extrakciót igényel. Ez utóbbi lényege, hogy a vegyület lipofil kvaterner ammóniumsók jelenlétében semleges pH tartományban ionpárként átextrahálható diklór-metánba. A karbapenemek izolációjának bonyolultságára példaként álljon itt az OA-család. Az ábrán látható, hogy 90 l fermentléből a hosszadalmas tisztítás eredményeképpen mindössze néhány milligrammot lehetett az egyes anyagokból kinyerni:
A természetes származékok biológiai hatása, szerkezet-hatás összefüggései
A természetes karbapenemek szerkezet-hatás összefüggései bonyolultabbak a penicillinekénél és kefalosporinokénál: két szubsztituens és eggyel több aszimmetria centrum szerepel bennük, viszont a változások eléggé szisztematikusak. A következő két ábrán általános összefoglalást láthatunk a szerkezeti elemek hatásáról. Az első ábrán a szerkezeti hatásokat összefoglalva láthatjuk, míg az utóbbin a C-2 és C-6 szubsztitáció hatását láthatjuk csoportokba foglalva: a kettőskötés jelenléte a C-2 oldalláncban, a kén oxidációs állapota, illetve etil vagy izopropil, szabad hidroxi vagy szulfátészter a C-6 atomon.
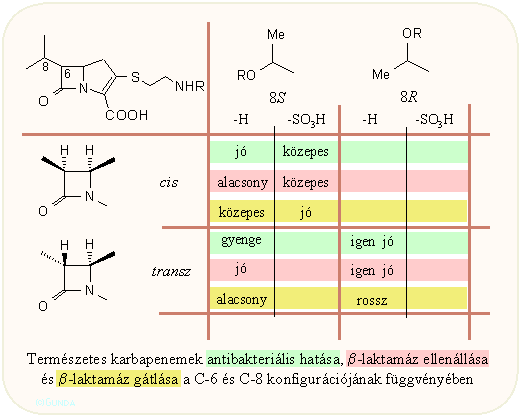
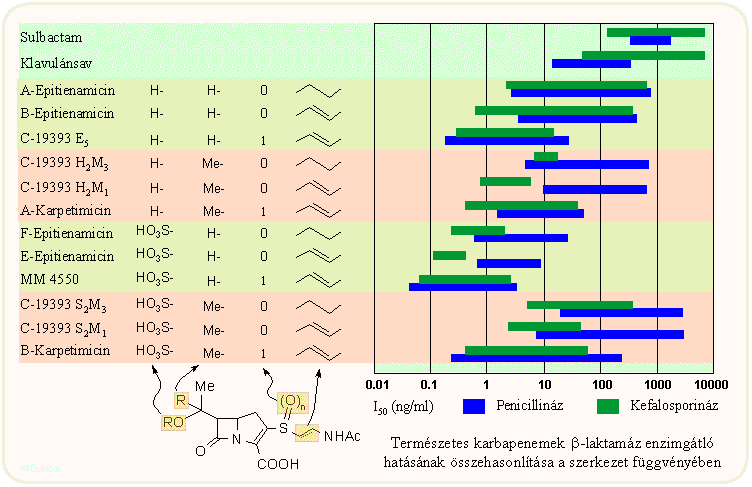
A táblázatokhoz azok áttanulmányozása alapján az alábbi általánosítások, következtetések fűzhetők hozzá:
- Jó antibakteriális hatás általában a cisz-8S vagy transz-8R kombinációnál várható; az utóbbinál a legjobb a β-laktamázzal szembeni ellenállás (tienamicin)
- A szabad amino csopotot tartalmazó C-3 ciszteamin oldalláncú vegyületeknek magasabb az antibakteriális hatása, főleg Pseudomonas esetén (v.ö. tienamicin);
- A C-3 oldallánc telítettsége aránylag kevéssé befolyásol;
- A C-3 oldalláncban a szulfoxid jelenléte erősen megnöveli a β-laktamáz enzimgátló hatást (pluracidomicinek);
- A második metil csoport a C-8 atomon lecsökkenti az enzimgátló hatást;
- A 8-OH csoport szulfonálása megnöveli a TEM és egyéb β-laktamázokkal szembeni ellenállóképességet;
- A 8-OH csoport nem okvetlenül szükséges a bioaktivitáshoz (v.ö. PS család), sőt a C-6 atomon telítetlen etenil csoport is lehet (asparenomicinek).