Kefalosporinok 1.
Felfedezés, természetes származékok
A penicillin már a kórházi gyakorlatban volt, amikor 1948-ban Szardinia szigetén az olasz Giuseppe Brotzu, a cagliari egyetem bakteriológia professzora a tengervíz baktériumflóráját tanulmányozta egy szennyvízcsatorna beömlési helyénél. Az egyik izolált Cephalosporium acremonium (ma Acremonium chrysogenum) törzsről kiderült, hogy egy Gram-pozitív és -negatív baktériumokra egyaránt ható anyagot választ ki. Mai szemmel elképzelhetetlen módon, Brotzu a kultúra szűrletének nyers koncentrátumát bátran alkalmazta intravénásan tífuszban, paratífuszban és brucellózisban szenvedőkön. A kezelés javulással járt, főleg tífusz esetén. Brotzunak a további komplexebb vizsgálatokhoz nem volt lehetősége, s a törzset a brit Medical Research Council közvetítésével Floreynak juttatta el, aki akkor Oxfordban a Sir William Dunn School of Pathology professzora volt, ott, ahol a penicillin klinikai vizsgálatait is végezték. A C. acremonium és antibakteriális anyagának felfedezését Brotzu a Lavori dell'Istituto d'Igiene di Cagliari, egy mindössze egy számot megért folyóiratban írta le.
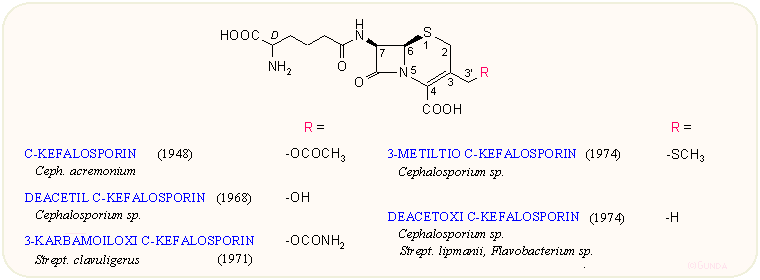
A további vizsgálatok során kiderült, hogy a törzs többféle antibiotikus hatású anyagot is termel. Ezek közül a P-kefalosporin és néhány minor komponens gyenge a Gram-pozitív baktérium ellenes hatást mutató szteránvázas és ma is használt fuzidinsavval rokon vegyületeknek bizonyult. A következő izolált anyag az N-kefalosporin volt, amelyről csakhamar bebizonyosodott, hogy egy új oldalláncot tartalmazó penicillin, s ez volt felelős a Brotzu által detektált hatásért. A vegyületet később N-penicillinnek keresztelték át, s kiderült az is, hogy azonos a közben Amerikában, az Eli Lilly kutatói által a Cephalosporium synnematumból izolált B-szinnematinnal. Az N-penicillin labilis vegyület, s bár jól hat S. typhi és egyéb Gram-negatív baktériumok ellen, a kezdeti humán klinikai próbálkozásoktól eltekintve nem került felhasználásra. Lökést adott viszont azoknak a kutatásoknak, miszerint a penicillin oldalláncának módosításával jelentős hatásspektrum változást lehet elérni. Az N-penicillin kromatográfiás tisztítása, koncentrálása során fedezték fel a C-kefalosporinnak keresztelt újabb anyagot, amiről csakhamar kiderült, hogy kémiailag közelálló, de nem azonos a penicillinekkel. A C-kefalosporin antibakteriális hatása az N-penicillinnek csak tizede volt, viszont kémiailag jóval stabilabbnak bizonyult s ellenállt a penicillináz enzim hatásának is. Aránylag gyenge hatása, a Gram-negatív hatás hiánya, de leginkább az éppen akkor, az 50-es évek végén előretörő félszintetikus penicillinek miatt lassan haladt előre a felhasználáshoz vezető úton. A C-kefalosporin pontos szerkezetét csak 1961-re állapították meg Abraham és mtsai kémiai úton, valamint Hodgkin és Maslen röntgenkrisztallográfiával. Az ábrán a C-kefalosporin mellett néhány minor izolátum is látható.
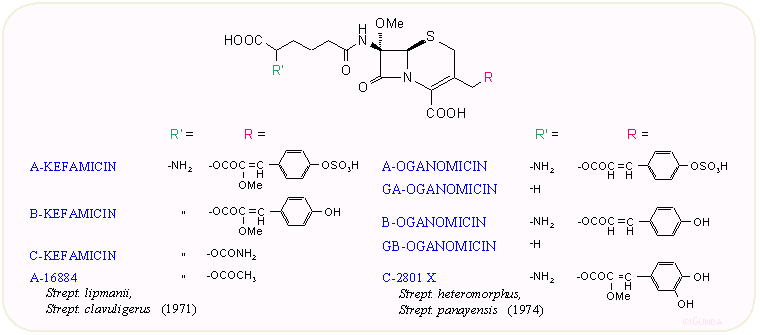
1971-ben az Eli Lilly kutatói, Nagarayan és munkatársai találtak rá egy Streptomyces lipmanii törzsben három új β-laktám antibiotikumra, amelyeket kefamicineknek neveztek el. Érdekes volt egyrészt, hogy egy új mikroorganizmus családról (sztreptomicéták, sugárgombák) volt szó, másrészt a vegyületek igen ellenállóak voltak a β-laktamáz enzimekkel szemben. A vegyületekben új volt a 7α-metoxi csoport jelenléte, valamint az eddigiektől eltérő 3-oldallánc is. Ez a felfedezés indította el a hetvenes években a β-laktamáz enzimmel szemben stabil, széles sávú kefalosporinok kifejlesztését. A továbbiakban még több minor kefamicin típusú antibiotikumot leírtak, elsősorban japán szerzők. Ezek közül említésre méltóak még az oganomicinek. Gyakorlatilag csak a C-kefamicin jelentős.
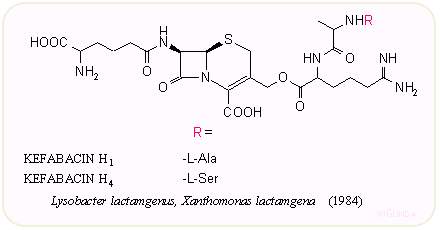
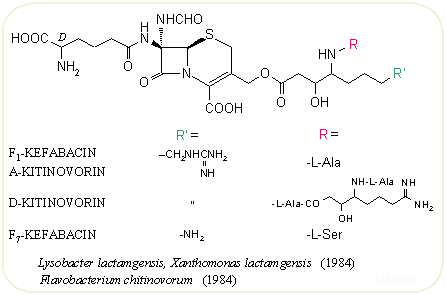
A mikrovilág szereplőinek mind kiterjedtebb tesztelése közben találtak rá a japán Takeda és Shionogi kutatói az érdekes oligopeptid oldalláncú kefabacinokra és a velük részben azonos kitinovorinokra. Mint a nevük is mutatja, ezeket baktériumok termelik, s egy újabb 7α-szubsztituens, a formilamino csoport is megjelenik a molekulák egy részében – ez szintén a β-laktamáz enzimmel szembeni ellenállóképességet növeli. A 6α-formilamino csoport használatával több szintetikus penicillinben és kefalosporinban is próbákoztak. A közel negyven izolált anyag közül alább láthatunk néhány jellemző szerkezetet:

Kémiai tulajdonságok
A kefalosporinok és penicilinek kémiai tulajdonságaiban természetesen sok közös vonás található. A következőkben elsősorban a különbségeket, a kefemekre jellemző tulajdonságokat emeljük ki.
A kefem Δ3 → Δ2 kettőskötés izomerizációja mind hasznos, mind zavaró is lehet. A kötésvándorlás általában bázikus közegben lép fel, így az észterek hidrolízisénél vagy akrilnitril és hasonló vegyületek Michael addíciójánál.  Ez kellemetlen, mivel a Δ2 származékoknál gyakorlatilag megszűnik a biológiai hatás. Bizonyos esetekben viszont hasznos is lehet, mivel a C-2 és C-3' atomok reakció képességét eltérően befolyásolja, amit pl. új funkciós csoportok bevezetésénél előnyösen ki lehet használni. A kötés egyébként egy oxidációs – redukciós folyamattal visszahelyezhető: a szulfoxidoknál ugyanis spontán a Δ3-as helyzetbe vándorol. Újabban japán szerzők kimutatták, hogy ez a folyamat az aktív észterek esetében, a 3'-szubsztituenstől függően kisebb-nagyobb mértékben a gasztrointesztinális traktusban még felszívódás előtt lejátszódik, s ez magyarázza, hogy nemegyszer e származékok in vivo gyengébben hatnak, mint ahogy ezt az anyavegyület alapján várhatnók.
Ez kellemetlen, mivel a Δ2 származékoknál gyakorlatilag megszűnik a biológiai hatás. Bizonyos esetekben viszont hasznos is lehet, mivel a C-2 és C-3' atomok reakció képességét eltérően befolyásolja, amit pl. új funkciós csoportok bevezetésénél előnyösen ki lehet használni. A kötés egyébként egy oxidációs – redukciós folyamattal visszahelyezhető: a szulfoxidoknál ugyanis spontán a Δ3-as helyzetbe vándorol. Újabban japán szerzők kimutatták, hogy ez a folyamat az aktív észterek esetében, a 3'-szubsztituenstől függően kisebb-nagyobb mértékben a gasztrointesztinális traktusban még felszívódás előtt lejátszódik, s ez magyarázza, hogy nemegyszer e származékok in vivo gyengébben hatnak, mint ahogy ezt az anyavegyület alapján várhatnók.
A kefalosporin-szulfoxidok és szulfonok a penicillinekhez hasonlóan, enyhe oxidációval állíthatók elő (H2o2, perecetsav, 4-klór-perbenzoesav, stb.). A szulfoxidok könnyen redukálhatók (pl. PBr3), a szulfonok redukciójára nem ismeretes módszer.
A kefalosporinok C-2-es szubsztitúcióját viszonylag keveset tanulmányozták, mivel ezeknek a vegyületeknek a biológiai hatása legtöbbször nem jobb a szubsztituálatlan származékokénál, bár manapság a HLE és β-laktamáz enzimgátló hatású kefemek keresése miatt ismét többet foglalkoznak velük. A fontosabb származékokat és reakciókat az alábbi ábrán foglaljuk össze. Wright és mtsai 1971-ben írták le a 2-exometilén származékokat, amelyek könnyen továbbalakíthatók. A 2-exometilén csoport bevitele Mannich reakcióval, formaldehid és egy szek. amin só keverékével lehetséges. A redukcióval kapható 2-metil származékok elég jó hatásúak, ilyen pl. az 1-oxakefem sorba tartozó totálszintetikus 2β-metil származék (OCP-9-176). A 2-exometilén származékok kettőskötése igen reaktív, könnyen epoxidálható stb. Mind a kefemek, mind az oxidált származékok halogénezhetők a C-2 helyzetben, pl. szulfurilkloriddal, halogénekkel vagy NClS, és hasonló szerekkel. Alkoholok jelenlétében halogénezve 2α-alkoxi származékok keletkeznek. Etilakriláttal, akrilnitrillel Michael addició játszódhat le a mind a szulfidoknál, mind a szulfoxidokkal vagy szulfonokkal, ekkor a C-2 termék mellett kötésvándorlással egybekötött C-4 szubsztitúció is lejátszódhat. Erős bázis melletti alkilezés is 2- és/vagy 4-szubsztituált terméket eredményez.

Kémiailag igen jelentősek a 3-as helyzetben végzett változtatások. A természetes kefalosporinokban itt 3-acetoximetil, a kefamicinekben karbamoilmetil vagy más alk(en)iloximetil csoport van, a félszintetikus származékokban igen sok helyettesítést találunk, mivel alkalmas szubsztitúcióval egyrészt az antibakteriális hatás fokozható, másrészt a vegyület farmakokinetikája is igen függ e szerkezeti résztől. A 3-acetoxi csoport S és N nukleofilekkel a szokott módon cserélhető, a nukleofil partner jellegétől függően könnyebben vagy nehezebben. Lehet előzetesen trimetilszilil-jodiddal in situ jodid vagy BBr3-dal bromid származékot képezni és azt reagáltatni. Az acetoxi csoport enzimatikusan, vagy mind savas, mind lúgos körülmények között hidrolizálható, azonban savas közegben, szabad savak esetén igen gyorsan laktonképződés játszódik le.
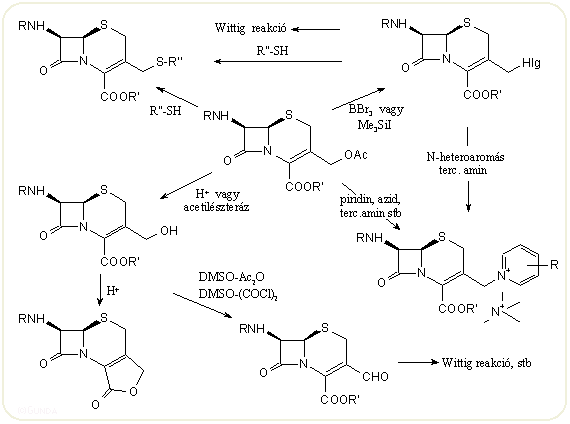
Az oxidációval kapható aldehidek vagy a 3-CH2-halogén származékok Wittig reakciójával előállítható 3-vinil származékok orálisan is jól felszívódnak, ezért több harmadik-negyedik generációs orális kefalosporin ilyen szerkezetű. A ródium-katalizált dekarbonilezéssel kapható 3-szubsztituálatlan kefem viszont a fontos ceftizoxim alapanyaga.