Penicillinek 3.
Félszintetikus penicillinek
A G- és V-penicillint ma is a Penicillium chrysogenum segítségével, fermentációs úton termelik, fenilecetsavnak ill. fenoxiecetsavnak a fermentléhez való adagolásával. Minden egyéb penicillint a 6-APS kémiai acilezésével állítanak elő. A 6-APS-at magát az 50-es években fedezték fel, ill. izolálták. A fermentációs úton kapott penicillin enzimatikus deacilezését a 60-as évektől kezdve alkalmazzák, újabban szilárd matrixhoz kötött enzim segítségével. A β-laktám gyűrű érzékenysége miatt a kémiai hidrolízis iparilag is alkalmazható megoldása 1970-ig váratott magára, amikoris Weissenburger és van der Hoeven a 6-acilamido csoportból képzett iminoéterrel oldotta meg a problémát. Mint az ábrán látható, a penicillin karboxil csoportját észter formában védeni kell (erre igen alkalmasak a szilil-észterek, mivel a befejező feldolgozás során spontán hidrolizálnak), majd az amidot foszfor(V)kloriddal és ezt követően metanollal vagy butanollal reagáltatva imino-éter származék képződik. Ebből enyhe savas hidrolízissel egy lépésben 6-APS keletkezik:
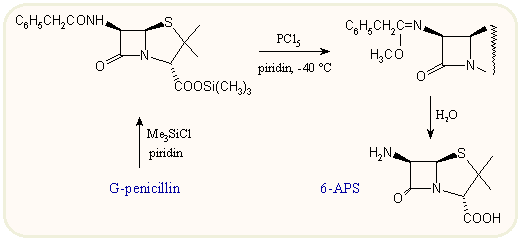
A penicillinek aminocsoportjának acilezése a peptidkémiából általában jól ismert acilezési eljárásokkal végezhető. Igy alkalmazható a klasszikus Schotten-Bauman féle acilezés savkloriddal, bázis jelenlétében vizes-szerves vegyes fázisban, a vegyes anhidrid módszer klórhangyasav észterekkel és a DCCI módszer, ez utóbbi esetben aktív észteren (pl. hidroxi-benztriazol) keresztül. Kapcsolóreagensnek használható még az EEDQ, N-metil-2-klórpiridinium jodid, N-meziloxibenztriazol, stb. Egy-egy adott oldalláncra jellemző speciális módszert a szóbanforgó helyen említünk meg.
A következőkben áttekintjük a fontosabb félszintetikus penicillineket. Gyakran fogunk hivatkozni a Gram-pozitív vagy Gram-negatív baktériumokra, ennek a megkülönböztetésnek a mibenlétéről a β-laktám antibiotikumok hatásmechanizmusáról szóló részben beszélünk bővebben. Meg kell még említeni, hogy az in vitro hatásvizsgálat során a kapott MIC (minimális gátló koncentráció) értéke nagyon függhet a tesztelés módszerétől (táptalaj összetétele, pH-ja). Az antibiotikumoknak jelentős lehet a proteinkötődése (vérplazma és szöveti fehérjék), ezért alaposabb in vitro vizsgálatnál a táptalajhoz humán plazmát is szokás adagolni. In vivo a szérumkötött antibiotikum hatástalan (a kötődés maga természetesen egy egyensúlyi folyamat). Ez a folyamat lehet hátrányos (a ható koncentráció alá csökken az antibiotikum mennyisége), de előnyös is (lassú felszabadulás → depo hatás). In vivo a hatást befolyásolja még a felszívódás, adszorpció, eloszlás, metabolizmus és kiválasztódás, és nem utolsó sorban a kísérleti állat faja. Pl. a kloxacillin szérumkötődése egérben jóval alacsonyabb, mint emberben, a nafcillin esetén pont fordítva van. Látható tehát, hogy a hatást, a farmakokinetikát és -dinamikát igen sok faktor befolyásolja, s egy anyag hatásának kiértékelése komoly és nem egyszerű feladat.
A félszintetikus penicillineket több csoportra oszthatjuk: a kémiai megkülönböztetésen túlmenően egyrészt az antibakteriális hatásspektrum szélessége, másrészt a β-laktamáz enzimmel szembeni viselkedés (ellenállás és/vagy gátlás) alapján. Természetesen ezek a csoportok eléggé átfednek, hasonlóképpen a néhol használt első, második, harmadik generációs osztályozáshoz. A G-penicillin a legáltalánosabban használt korai penicillin volt, savérzékenysége és keskeny spektruma miatt önmagában manapság már csak szűk körben indokolt alkalmazni (érzékeny streptococcusok, szifilisz, gonorrhea), bár innen is egyre inkább kiszorul. Lassan oldódó sói (prokain, dibenzil-etiléndiamin stb) i.m. depó készítményként voltak forgalomban, acetoxi-metilésztere Magyarországon Maripen néven van forgalomban. A V-penicillin és a többi fenoxi-acetilpenicillin gyakorlatilag csak Gram-pozitív törzsekre hat. Ezek már jóval savstabilabbak, a pheneticillinnek pl. kb 50% változatlan formában választódik ki a szervezetből. Ezek a penicillinek mind érzékenyek a rezisztens baktériumok termelte β-laktamáz enzimre.

A félszintetikus penicillinek fejlesztése során az első stádiumban nem a hatásspektrum szélesítése, hanem a β-laktamáz enzimmel szembeni ellenállás növelése volt a cél. A Staphylococcusok termelte β-laktamázzal szemben igen ellenálló első, és még ma is használt származék a G-penicillin di-orto-metoxi származéka, a meticillin volt (1960). Savérzékenysége miatt csak injekcióban alkalmazható (a meticillinnel szemben is rezisztens Staphylococcus törzsek (MRSA) már komoly kórházi problémát is okozhatnak). Hasonló laktamázstabil származékok a ma már nem használt nafcillin és ancillin. A hatvanas évek elején jelentek meg a sokáig használt izoxazolil penicillinek, az oxacillin és valamivel jobb halogénezett származékai. Ezek rezisztens Staphylococcusokra, β-hemolitikus Streptococcusokra is igen jól hatnak, orálisan is jól felszívódnak. Mint a későbbi vizsgálatokból kiderült, hatásosságuk forrása az, hogy a többi passzív laktamázstabil penicillinnel ellentétben az izoxazolil penicillinek a β-laktamáz enzimek működését aktívan gátolják, így mint β-laktamáz enzim inhibitorok is felfoghatók. Emiatt ezeket alkalmazták β-laktamázra érzékeny penicillinekkel vagy kefalosporinokkal szinergikus kombinációban is.
A G-penicillin oldalláncának α helyzetébe egy amino csoportot helyezve igen megnő a molekula savstabilitása, másrészt az antibakteriális spektrum erősen kiterjed a Gram-negatív irányba. A D(-) izomer jóval aktívabb az L(+) izomernél. Az alapmolekula az ampicillin (α-amino-benzilpenicillin, Semicillin), s bár Pseudomonas törzsekre nem hat, ez volt az első olyan széles spektrumú penicillin, amely jól használható Haemophilus, Bordatella, Brucella, Shigella, Salmonella, E. coli, P. mirabilis, etc. törzsek ellen, nem hat azonban β-laktamáz enzimet termelő baktériumokra. Az ampicillinhez hasonló származék a részlegesen redukált aromás gyűrűt tartalmazó epicillin. A gasztrointesztinális traktusból közepesen szívódik fel, azonban prodrog formátumban alkalmazva sokkal jobb szérum és szöveti szintet lehet elérni. Ilyenek az aktív észterei (Pivampicillin, Talampicillin, Bacampicillin). Az aktív észterek között különleges helyet foglal el a már említett sultamicillin (Unasyn), amelynél az észtercsoport a β-laktamáz gátló penicillánsav szulfon (sulbactam), így ez egy szinergikus kombináció is egyúttal, mivel a felszabadult penicillánsav szulfon már mint önálló molekula hat.
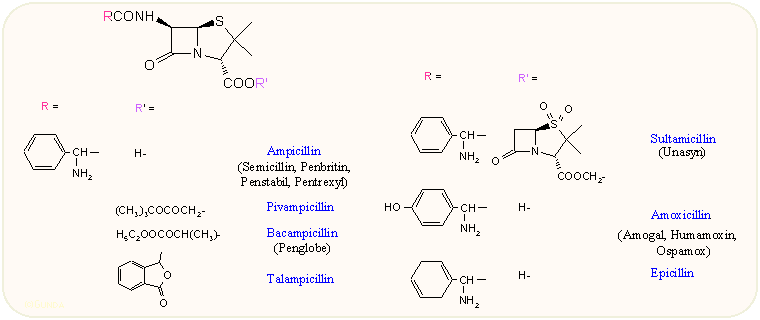
Az amoxicillin, amely az ampicillin p-hidroxi származéka, hatásspektrum szempontjából gyakorlatilag megegyezik az ampicillinnel, viszont orális adagolás esetén jobb a felszívódás, magasabb az elérhető vér- és vizeletszint (6 óra alatt mintegy 60-80%-a változatlan formában ürül ki a vesén keresztül).
Az α-amino-benzilpenicillin féleségek szintézisénél, az acilező aminosavat (fenilglicin) az aminocsoportján védeni kell, akárcsak egy szokásos peptidszintézisnél, majd ezt utólag el kell távolítani. Meg kell azonban ehelyt említenünk két jellemző előállítási módot. Az egyik tulajdonképpen a közismert vegyes anhidrid módszer, az amino csoport védésére azonban az ún. Dane-sót alkalmazza. A vegyes anhidrides kapcsolás után a védőcsoport igen enyhe savas hidrolízissel eltávolítható. 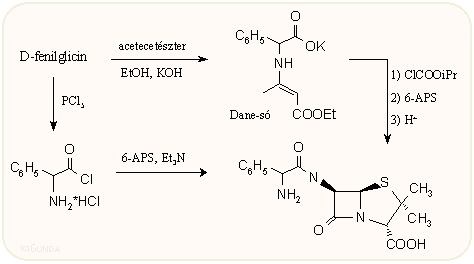 A másik módszer védés nélkül savkloriddal acilez, jobban mondva az amino csoportot só formájában védi. Az aminosav klorid hidrokloridok csak bizonyos aminosavak esetén stabilak, szerencsére a fenilglicin ezek közé tartozik. A savklorid hidroklorid kloroformban foszfor(V) kloriddal kvantitív hozammal állítható elő.
A másik módszer védés nélkül savkloriddal acilez, jobban mondva az amino csoportot só formájában védi. Az aminosav klorid hidrokloridok csak bizonyos aminosavak esetén stabilak, szerencsére a fenilglicin ezek közé tartozik. A savklorid hidroklorid kloroformban foszfor(V) kloriddal kvantitív hozammal állítható elő.
Az aminocsoport helyett savas csoportot helyettesítve az oldalláncba ismét megváltozik a hatásspektrum. E család három legfontosabb tagja, a carbenicillin, sulbenicillin és ticarcillin olyan törzsekre is hatnak, amelyekkel szemben az ampicillin nem vagy kevésbé hatásos. Igy első helyen kell említeni a Pseudomonas ellenes hatást, valamint az indol-pozitív Proteus és Klebsiella törzseket. A Gram-pozitív hatás is más, mivel hatnak β-laktamáz termelő Staphylococcus törzsekre, viszont lecsökkent az aktivitásuk egyes Streptococcusokra. Érdekes módon a két diasztereomer hatása itt egyforma. Ezek a vegyületek per os nem szívódnak fel, csak intramusculárisan vagy intravénásan adhatók be, viszont a különböző aktívészter már igen.
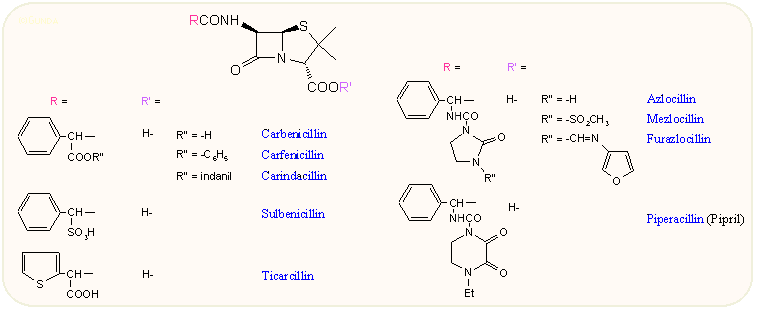
A hetvenes évek elején született ureidopenicillinek az ampicillin ureid származékai, s ezek szintén jelentős, a carbenicillinhez hasonló vagy jobb Pseudomonas ellenes hatással rendelkeznek, megtartva az ampicillin Streptococcusok ellenes hatását. A jobb hatás oka, hogy ezek a származékok jobban áthatolnak a Gram-negatív baktériumok sejtfalán. A legelterjedtebb közülük a piperacillin, amelynek hatása már megközelíti az aminoglikozidokét.
Említettük, hogy a penicillinek antibakteriális hatásához nélkülözhetetlen a 6α-acilamido oldallánc, ezt mással helyettesítva a hatás gyakorlatilag megszünik. Az egyetlen kivétel az amidino penicillinek, amelynek egyetlen forgalomban levő tagja a mecillinam. Ennek gyakorlatilag elhanyagolható a Gram-pozitív hatása, viszont igen aktív E. coli, Proteus, Klebsiella, Salmonella és Shigella-félékre. Főleg húgyúti fertőzésekben használják. Pivaloiloximetil észterének (pivmecillinam) sokkal jobb az abszorpciója.
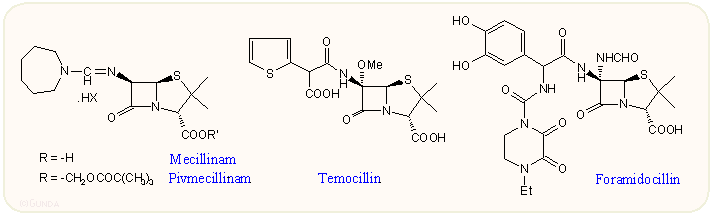
A természetes kefamicinek mintájára készítettek 6α-metoxi szubsztituált penicillineket is, az egyetlen bevált származék a temocillin. A 6α-szubsztitúció csökkenti az eredeti hatást, ez sajnos főleg a Gram-pozitív baktériumoknál mutatkozik meg, a hatáscsökkenés a Gram-negatív oldalon nem jelentős, s ezt is ellensúlyozza a megnövekedett ellenállás a legtöbb típusú β-laktamázzal szemben.
Mint már említettük, ha az ampicillin típusú fenilglicin oldallánc fenilcsoportjába egy hidroxilt viszünk be, a kapott p-hidroxi-fenilglicin származékok az antibakteriális hatás változatlanul maradása mellett sokkal jobb farmakokinetikai sajátságokat mutatnak. Még egy hidroxil csoport bevitele viszont drasztikusan megjavítja a Gram-negatív antibakteriális hatást. A legjobban a 3,4-dihidroxi-fenil származékok (az ún. katechol típus) váltak be. E vegyületek viszont érzékenyek a β-laktamáz enzimekre. A Beecham kutatói ezt a már ismert 6α-szubsztitúcióval védték ki: a foramidocillinbe (BRL 36650), ami tulajdonképpen egy továbbfejlesztett piperacillin származék, egy 6α-formamido csoportot építettek be. Ez utóbbi egyébként szintén a természetből ismert, mivel a kefalosporin családba tartozó kitinovorinok és kefabacinok is tartalmazzák.
E katechol típusú vegyületek felerősödött Gram-negatív kórokozók ellenes hatása a sejtfalon való áthatolóképesség megnövekedésével van kapcsolatban, nagyon jól hatnak különbözű Pseudomonas fajokra. A hatásnövekedés fokozottan jelentkezik vashiányos környezet esetén, ami arra utal, hogy az antibiotikum bejutásában szerepe lehet a sejt vas anyagcseréjével kapcsolatos külső membránproteineknek. Sajnos a foramidocillin toxikusabb volt az átlagos penicillineknél és stabilitási gondok is voltak vele, így végül nem került forgalomba.
A fentebb ismertetett és az azokon túlmenő 20-30 egykor használt félszintetikus penicillinből mára alig néhány darab maradt (ampicillin, amoxicillin, piperacillin, stb.). Ennek oka, mint azt majd később látni fogjuk, a β-laktamázgátlók felfedezése volt.