Penicillinek 2.
A penicillin 2-es helyzetében a két metil csoportot más alkil csoporttal helyettesítve az antibakteriális hatás nem éri el a természetes 2,2-dimetil származékét. Igen jelentős volt viszont az a felismerés, hogy a 2β-metil csoportot szubsztituálva az antibakteriális hatás lecsökken ugyan, viszont a cserében a vegyületek jelentős ß-laktamáz enzim gátlással rendelkeznek, pl. tazobactam. Az alapvegyületül szolgáló 2β-klórmetil penicillánsavat a megfelelő szulfoxidnak benzilkloriddal való reakciójával lehet előállítani:

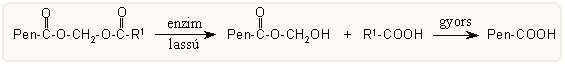
A 3-as helyzetű karboxil csoportot sok irányba átalakították, s ez kevés kivételtől eltekintve az antibakteriális hatás megszűnésével jár. Az egyszerű alkilészterek, savamidok, stb. –amelyek a peptidkémiából is ismert enyhe módszerekkel állíthatók elő –in vivo hatása igen kicsi. Ellenben egyes kettős észterek, az ún. aktív észterek in vivo bizonyos aspecifikus észterázok hatására lassan hidrolizálnak a plazmában. Ennek jelentősége abban rejlik, hogy orális alkalmazás esetén jelentősen megnő a felszívódás sebessége a gasztrointesztinális traktusból, majd a lassú felszabadulás miatt a kiürülés is időben elhúzódó, ami ritkább adagolást tesz lehetővé. Az enzimes hidrolízis során itt először egy labilis hidroximetil észter képződik, amiből magától felszabadul a szabad sav:
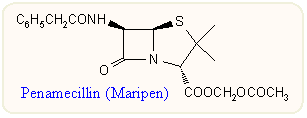 Az észtercsoport hidro- vagy lipofilitásának változtatásával széles tartományban változtathatók a felszívódási viszonyok. Az első széleskörben is alkalmazott ilyen prodrug származékot, a G-penicillin acetoxi-metilésztert (penamecillin, Maripen) angol kutatók írták le a hatvanas évek közepén. Az újabb pivaloiloxi-metil és egyéb származékokról a félszintetikus penicillineknél találhatunk további példákat. Az utóbbi évek fejlesztései közül kiemelésre méltó a sultamicillin és néhány hasonló származék, amelyben az aktívészter rész két különböző aktív molekulát, az antibakteriális hatású ampicillint és a β-laktamáz gátló szulbaktámot kapcsolja össze (ld. a félszintetikus származékoknál).
Az észtercsoport hidro- vagy lipofilitásának változtatásával széles tartományban változtathatók a felszívódási viszonyok. Az első széleskörben is alkalmazott ilyen prodrug származékot, a G-penicillin acetoxi-metilésztert (penamecillin, Maripen) angol kutatók írták le a hatvanas évek közepén. Az újabb pivaloiloxi-metil és egyéb származékokról a félszintetikus penicillineknél találhatunk további példákat. Az utóbbi évek fejlesztései közül kiemelésre méltó a sultamicillin és néhány hasonló származék, amelyben az aktívészter rész két különböző aktív molekulát, az antibakteriális hatású ampicillint és a β-laktamáz gátló szulbaktámot kapcsolja össze (ld. a félszintetikus származékoknál).
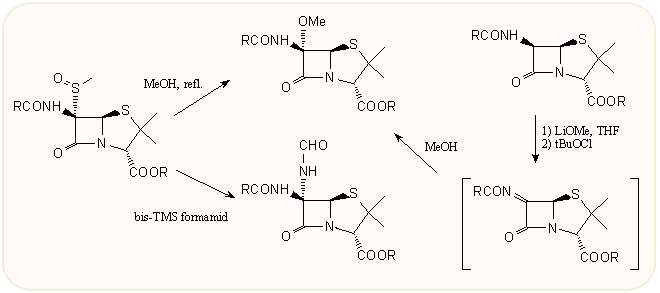
Kétségkívül a 6β-amino csoport változtatása a legfontosabb. Antibakteriális hatása csak az acilamido származékoknak van (1-2 amidino származék kivételével), ezekkel kiemelten mint félszintetikus származékokkal foglalkozunk később. Az aminocsoport alkilezése, karbamidok, uretánok képzése, diazotálás és ebből további átalakítások stb, epimerizálás 6β-amidokká a hatás elvesztésével jár, ez már a penicillin kémia kezdetén kiderült, ezért ezt a vonalat a 70-es évek elejéig nem nagyon erőltették. A helyzet akkor változott meg, amikor felfedezték a 7β-metoxi csoportot tartalmazó kefalosporinokat, a kefamicineket, valamint néhány évvel később a 6β-halogén-penicillinek β-laktamáz enzimgátló, és a nyolcvanas évek közepén a 7β-metoxi és halogén kefemek HLE enzimgátló hatását. Ekkor ugrásszerűen megindult a 6-os atom szubsztitúciójának vizsgálata (és az analóg kefem C-7 származékoké). A 6-amino csoport diazotálása vezet talán a legsokrétűbb átalakításokhoz, ezekből a reakciókból mutat be egy csokorra valót a teljesség igénye nélkül az alábbi ábra:

Hatástanilag két 6β-szubsztituált penicillin érdekes, a félszintetikus származékoknál tárgyalt temocillin és formidacillin. Az előbbi metoxi, az utóbbi formamido csoportot tartalmaz a 6β helyzetben. A 6β-metoxi származék több módon is kialakíható, a meglevő 6β-acilamido oldallánc mellé is be lehet bevinni a kívánt szubsztituenst, erről bővebben a kefamicinek előállításánál lesz szó. Ezek legtöbbjét a penicillineknél is lehet alkalmazni, pl. a metilszulfenil csoport cseréjével, vagy még egyszerűbben, az amid oldalláncban erős bázissal aniont kialakítva és ezt tBuOCl-tal oxidálva, majd az intermedier iminre metanolt addícionálva:
A penicillinek szintézise
Az első totálszintézis Sheehan és Henery-Logan nevéhez fűződik (1962), ebben a tiazolidin gyűrűt alakították ki először, majd a kulcslépésben a peptidkémiából is jól ismert diizopropil-karbodiimiddel zárták a β-laktám gyűrűt, igen alacsony hozammal.

Sokkal célravezetőbb 4-merkapto-azetidinonokból kiindulni, hiszen ezek könnyen előállíthatók a penicillinekből lebontással. Igy jóval egyszerűbben készíthetők a tiazolidin gyűrűben módosított származékok. A már említett Kamiya-diszulfid nukleofil ágensek, halogénezőszerek, stb. hatására könnyen reciklizálható. A labilis 3-klór-azetidinonok is reciklizálhatók Lewis-savakkal, például:
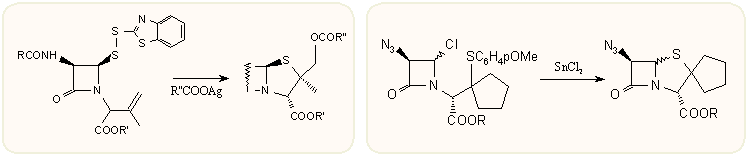
A biciklusos β-laktám származékok előállításának egyik gyakori módszere a ketén cikloaddíciója iminekre, a Staudinger reakció. Az ábrán például az azido-acetilkloridból in situ képzett ketén reagál a megfelelő iminnel és alakítja ki a penam vázat. A reakció sztereospecifitása erősen függ a reagensektől és a reakciókörülményektől.
