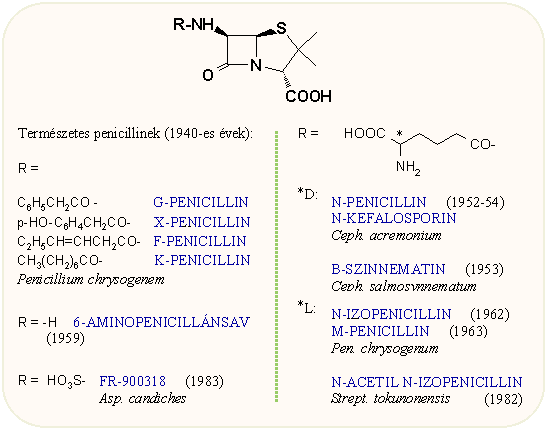
Penicillinek 1.
Felfedezés, természetes származékok
Fleming 1929-es közismert felfedezését követően a penicillin izolálására tett kezdeti kísérletek eredménytelenek voltak. A kérdéssel Florey és Chain 1938-ban Oxfordban ismét foglakozni kezdtek (később mindhárman Nobel díjat kaptak). A 40-es évek elején Oxfordban és az USÁ-ban párhuzamosan folyó izolációs és szerkezetmeghatározási munkák eredménye titkosítva volt, s csak a II. világháború után jelent meg összesítve a The Chemistry of Penicillin c. könyvben. A korai kutatási fázisban izolált penicillinek oldalláncai függtek az alkalmazott tápoldat összetételétől, az így kapott néhány eltérő penicillint betűkkel (G, X, K, F) különböztették meg. 1943-ban Oxfordban a benzilpenicillint, Amerikában a Squibb Institute-ban Wintersterner és McPhillamy a 2-pentenil-penicillint állította elő kristályos formában (az oxfordi történetről többet megtudhatsz itt.) A β-laktám szerkezetet előszőr Abraham és Chain javasolta 1943-ban, majd Hodgkin és Low igazolta röntgen krisztallográfiával. A következő ábrán a természetből eddig izolált penicillin származékok láthatók. Az alapvegyületet, a 6-amino-penicillánsavat az ötvenes évek végén izolálták, szerepét majd a félszintetikus származékoknál tárgyaljuk; a többi vegyület igen kis mennyiségben fordul elő a fermentlevekben, az aminoadipoil oldalláncú származékok tulajdonképpen a bioszintézis köztitermékei.
Az alábbi képen (A) a penicillin hatását láthatjuk: a Petri-csésze közepén néhány napig növelték a penicillint termelő Penicillium notatumot, majd egy sárga baktérium, Micrococcus luteum folyékony agaros tenyészetét öntötték a tetejére. Jól látható, hogy a Penicillium által termelt antibitikum mekkora inhibíciós zónát okozott. A penicillin hatásmechanizmusa a baktérium sejtfalszintézisének gátlásán alapul. A B képen egy aszexuálisan spórázó Penicillium féleség látható:
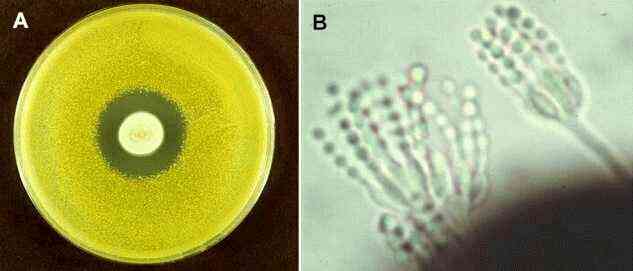
(kép: University of Edinburgh)
Kémiai tulajdonságok
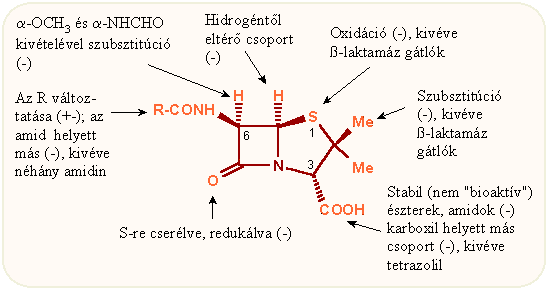
A penicillinekről általánosan elterjedt, hogy igen érzékeny molekulák, s legtöbbjük szobahőmérsékleten, vizes oldószerben elég gyorsan inaktiválódik. Ez igaz: a β-laktám gyűrű nukleofil jellegü reagensekkel szemben igen érzékeny, s ez általában gyors gyűrűfelnyíláshoz vezet. Le kell azonban egyúttal szögezni, hogy a β-laktám vázas vegyületekre ez így nem általánosítható. A szabad molekulák vízben csakugyan bomlékonyak, de nemvizes közegben, protonsavak vagy bázisok távollétében elég stabil anyagok. Mindazonáltal a penicillineknek igen sok, a β-laktám gyűrű felnyílásával együttjáró átrendeződését írták le, amelyek közül csak néhány fontosabbat foglal össze a következő ábra. Igy a penicillinkémia kezdetétől fogva ismertek az alkalikus vagy savas oldatban keletkező penicilloesavak – ezek képződését fémionok katalizálják –, penicillénsav, penillsav és penillosav, ezek pontos szerkezete természetesen az R csoport függvénye, és egymásba való átalakulásuk igen függ a reakciókörülményektől, pH-tól. Wolfe és mtsai fedezték fel az ún. anhidropenicillint, amely penicillinnek valamilyen aktivált savszármazékából, pl. vegyes anhidridből képződik trietilamin hatására.

Mielőtt röviden áttekintenénk a penicillin váz egyes atomjaihoz kapcsolódó fontosabb kémiai átalakításokat, tájékozódásul nézzük meg az ezen átalakításokhoz társuló antibakteriális hatásváltozásokat. Ezek közül kétségkívül a legjelentősebb a C-6 acil oldallánc cseréje, azaz a 6-amino-penicillánsav alapon megvalósított félszintetikus származékok előállítása, itt igen nagy a lehetőségek száma. Más pontokon már jóval kisebb a megengedett változtatások száma, az antibakteriális hatás legtöbbször csökken, bár bizonyos egyéb biológiai tulajdonságok, pl. a β-laktamáz enzimmel szembeni ellenállás, javulhatnak. A kénatom oxidálásával kapott szulfoxidok és szulfonok mint β-laktamáz és HLE enzimgátló vegyületek fontosak, hasonlóan a C-2 metilcsoporton szubsztituált származékok is. Biológiailag fontosak még az aktív észterek is, ezeket a megfelelő helyen tárgyaljuk.
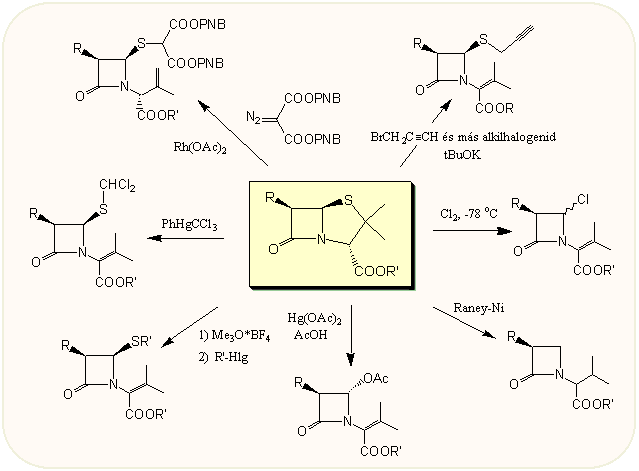
Főleg egyéb gyűrűrendszerrel rendelkező β-laktám származékok szintézisénél jelentősek a penicillinek tiazolidin gyűrűjének felnyílásával járó reakciók, a β-laktám gyűrű érintetlenül hagyása mellett. Az így kapott 2-azetidinon származékok u.i. eleve két aszimmetriacentrumot tartalmaznak, s így elkerülhetők a racém vegyületek szétválasztásának fáradalmai. A következő ábra a leghasználhatóbb ilyen reakciókat tartalmazza. Igy diazovegyületek ródium-acetát vagy réz sók jelenlétében felnyitják a tiazolidin gyűrüt. Reaktív halogenidek erős bázisok jelenlétében 4-S-alkil származékokhoz vezetnek. Az alacsony hőmérsékleten, néhány perces klórozással kapható 3-klór származékokat azonnal tovább kell alakítani. Raney nikkel hatására a penicillin deszulfurálható. A Hg(II)acetát hatására képződő 3-acetoxi származékok igen sokféleképpen továbbalakíthatók, ezért ezek általános kiindulási anyagként is tekinthetők más biciklikus származékok, pl. penemek szintézisénél, s kereskedelmi forgalomban is kaphatók.
Enyhe oxidáció hatására (pl. H2O2, NaIO4, KMnO4, szerves persavak, stb) sztereospecifikusan S(β) penicillin-szulfoxidok, ill. szulfonok képződhetnek. Mivel ezek antibakteriális hatása elhanyagolható, kezdetben nem foglalkoztak velük. Jelentőségük akkor nőtt meg, mikor felismerték, hogy kiváló alapanyagok további szintetikus manipulációkhoz: a tiazolidin gyűrű könnyen felnyitható, majd továbbalakíthatók kefalosporinokká vagy más irányba. A szulfonok közül egyesek jelentős β-laktamáz vagy HLE enzimgátlással rendelkeznek, erről később lesz szó.
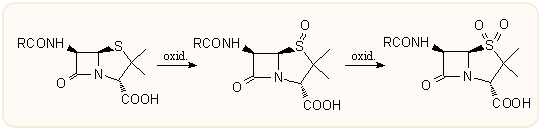
A ként szulfoxid formában tartalmazó tiazolidin gyűrű már könnyebben nyitható fel, a következő ábra tartalmazza összefoglalólag a penicillin-szulfoxidok néhány legjellemzőbb reakcióját. A reakciók alapja, hogy a szulfoxid 80-100 °C-ra melegítve reverzibilisen szulfénsavvá nyílik fel, s ez sokoldalúan reagálhat tovább. A legfontosabb talán az ún. Kamiya-diszulfid, amely 2-merkaptobenztiazol és penicillin-szulfoxid benzolban vagy toluolban történő több órás forralásával készíthető. A Kamiya-diszulfidok igen sokrétűen alakíthatóak tovább, amint arra később több példát is láthatunk s külön is összefoglaljuk.
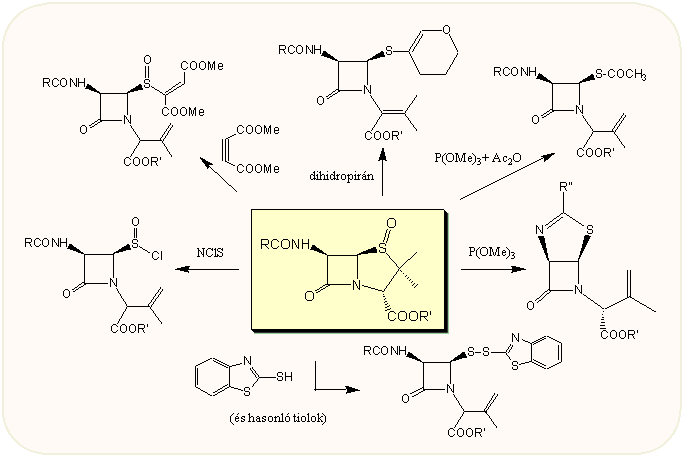
Redukciós körülmények között tiol ill. tiol származék képződik. Erre igen alkalmas a trimetilfoszfit. Az így kapható biciklusos vegyület szintén hasznos alapanyag, mivel a tiol funkciót tk.védett formában tartalmazza, egyúttal az eredeti 6β-oldallánc amid csoportja is blokkolva van, miközben az azetidinon nitrogénjén egyéb manipulációkat végezhetünk.