Kefalosporinok 2.
A 3-exometilén-kefemek könnyen képződnek közepes-jó hozammal 3-acetoximetil vagy 3-ariltiometil kefalosporinokból elektrolízissel, vagy Cr(III) sók, Zn-Hg couplé stb hatására, a Kamiya diszulfidból fotokémiai reakcióban, vagy az Eli Lilly eljárása alapján: penicillin-szulfoxidokból N-klórszukcinimiddel egy szulfenilklorid intermedieren keresztül:

A 3-exometilén-kefemek halogénekkel relative nehezen reagálnak. Legjelentősebb átalakításuk az ózonolízis. Az így kapott 3-hidroxi kefemek könnyen továbbalakítható az antibakteriálisan jelentős 3-klór és 3-metoxi származékokká, a 3-mezilát és -triflát pedig további átalakításokra alkalmas, főleg az utóbbi, amely alkenilsztannánokkal 3-vinyl és 3-butadienil származékokká alakítható.
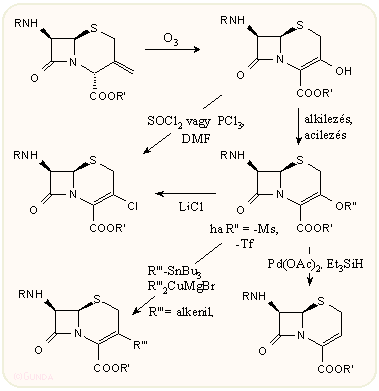
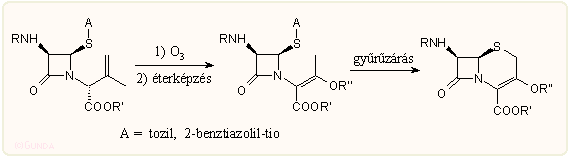
A 3-hidroxi származékok egy másik kialakítási módja, amikor egy még aciklikus származéknál végezzük el az N-szubsztituensen a szükséges átalakításokat, majd utána zárjuk be a tiazolin gyűrűt. A kiindulási N-propenil oldallánc, mint korábban láttuk, a penicillinek vagy szulfoxidjaik gyűrűnyitásánál keletkezik.
A 6-os helyzetben, a gyűrűannelációs pontban szubsztituált származékokat (fenil, feniltio, alkil stb) többnyire szintetikus kísérletek során, különböző cikloaddíciós β-laktám gyűrű felépítési kísérletekkel kapcsolatban állították elő a korai években. Biológiai szempontból érdektelenek és itt külön nem foglalkozunk velük.
A 7α-metoxi-kefalosporinok, vagyis a kefamicinek felfedezése után a 70-es években igen nagy számú 7α-szubsztituált származékot készítettek. Előljáróban el kell mondani, hogy a több száz vagy ezer származék elkészítése után kiderült, hogy a legjobb mégis a természetes metoxi (és a később felfedezett formamido) származék. Biológiailag a 7α-fluor származék is jó lenne, azonban ezek a vegyületek kémiailag túl bomlékonyak. Már a penicillineknél is bemutattunk két 6α-szubsztitúciós módszert (ld. ott), a következőkben áttekintünk néhány további 7α-szubsztituálási eljárást, természetesen ezek legtöbbje is nem csak a kefemek, hanem a penicillinek, monociklikus β-laktámok, oxakefemek stb. esetén is használhatók.
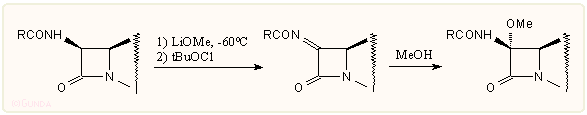
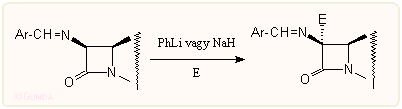 E módszerek alapja többnyire az, hogy a 7-pozícióban valamilyen úton karbanionos intermedier jöjjön létre. A korai kutatásokban erre Schiff-bázisokat használtak, amelyek könnyen reagálnak elektrofilekkel vagy Michael akceptorokkal, alkilezhetők stb., általában sztereoszelektív módon. A Schiff-bázisokhoz hasonlóan használhatók a 7-es helyzet aktiválására az acilamidokból könnyen előállítható iminoéterek is. A sok eljárás közül a metoxi csoport bevitelére a legegyszerűbbnek és legalkalmasabbnak talán a LiOMe/tBuOCl eljárás bizonyult: a LiOMe-dal képzett amid aniont tert-butilhipoklorittal oxidálva az acilimid köztitermékre in situ metanolt lehet addicionáltatni:
E módszerek alapja többnyire az, hogy a 7-pozícióban valamilyen úton karbanionos intermedier jöjjön létre. A korai kutatásokban erre Schiff-bázisokat használtak, amelyek könnyen reagálnak elektrofilekkel vagy Michael akceptorokkal, alkilezhetők stb., általában sztereoszelektív módon. A Schiff-bázisokhoz hasonlóan használhatók a 7-es helyzet aktiválására az acilamidokból könnyen előállítható iminoéterek is. A sok eljárás közül a metoxi csoport bevitelére a legegyszerűbbnek és legalkalmasabbnak talán a LiOMe/tBuOCl eljárás bizonyult: a LiOMe-dal képzett amid aniont tert-butilhipoklorittal oxidálva az acilimid köztitermékre in situ metanolt lehet addicionáltatni:
Szintézis módszerek
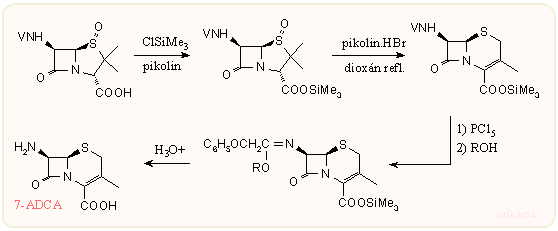
A kefalosporinok szintetikus előállításának első jelentős állomása volt, amikor az Eli Lilly kutatói, Morin, Jackson és munkatársai 1962-ben leírták a penicillin-szulfoxidok átalakítását 3-deacetoxi-kefalosporinokká. Ez azért volt jelentős, mert a kefalosporinoknál nem sikerült a fermentáció hozamát a penicillinhez hasonlóan megemelni. Az eredeti módszer szerint penicillin-szulfoxid észtereket ecetsavanhidrid jelenlétében 100 °C körüli hőmérsékleten melegítenek, amikoris több termék, így 2-szubsztituált penicillinek, kefam és a várt kefem vázas vegyület is keletkezik. A 70-es években slágertéma volt e reakció tökéletesítése úgy, hogy gyakorlatilag csak a kefem származék keletkezzen. Oldószerként gyakorlatilag csak dioxánt vagy ritkábban DMF-ot használnak, amelyben néhány órát kell 100 °C-on a penicillin-szulfoxid észtereket melegíteni alkalmas sav + bázis katalizátor jelenlétében. Nagyon sok ilyen katalizátort leírtak, főleg a szabadalmi irodalomban, ezek leginkább egy erős sav (ásványi sav, vagy szerves szulfon vagy foszfonsav származék) savanyú sói. Az egyik legjobban bevált módszer a Gist-Brocades cég eljárása: penicillin-szulfoxidot in situ szililészterré alakítanak, majd a gyűrűbővítést pikolin hidrobromiddal katalizálva végzik, végül kipreparálás nélkül a 7β-acilamido oldalláncot is eltávolítják iminoéter módszerrel:
A tiazolin gyűrű bezárásához vezető reakciókat, ezeket most a következő ábrán foglaljuk össze különösebb kommentár nélkül. Talán csak a legjelentősebb szorul kiemelésre, a 3-merkapto-benztiazol származékból (Kamiya-diszulfidból) vagy a tioszulfonátból történő reakció, ezek mindegyike bázis hatására ciklizál. Említésre méltó még ennek egy újabb változata, az N-keténből történő ciklizáció nukleofilek jelenlétében – ekkor ugyanis egy lépéssel a 3-szubsztitúció is megoldható, mivel ide lép be a jelenlevő nukleofil partner. Ez nemcsak a szokásos RO- vagy RS- ion lehet, hanem fémorganikus vegyület is (alkilkuprát vagy sztannát).
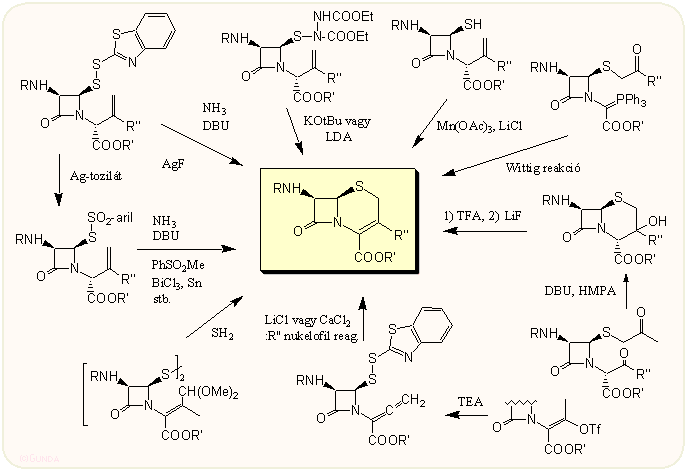
Ugyancsak itt emelnénk ki az általánosan használt Wittig típusú gyűrűzárást, amellyel a továbbiakban is gyakran találkozhatunk, hiszen az azetidinon gyűrű 4-es helyzetében más-más oldalláncot kialakítva az oxa- vagy karbakefemek, penemek és egyéb gyűrűrendszerek széles skálája állítható elő vele. Kiindulási anyagul a penicillineknél már említett N-2-metil-propenil származék szolgál, amely ózonos oxidáció majd redukció (pl. borohidrid) után a megfelelő hidroxi származékot szolgáltatja. Ez halogén csere után könnyen foszforánná alakítható. Ha az azetidinon gyűrű N atomja szabad, alkalmas glioxilsav észterrel kondenzálva is megkapható.
