Fizikai-kémiai tényezők és hatás 2.
A víz szerepe
Eléggé triviális dolog annak emlegetése, hogy az élet hordozója a víz. A víznek azonban sok olyan tulajdonsága van, amely kiemeli a többi oldószer közül, s nem csupán mint inert közeg szerepel.  Oldódás, felületaktivitás, H-híd kötések, hidrofób kötések, ionizáció, makromolekulák konformációja – mindezekhez köze van a víznek. A víznek nagy dipólusmomentuma és és dielektromos állandója van, és könnyen képez hidrogénhíd kötéseket. Ionos vegyületek igen jól oldódnak, mivel Coulumb törvénye értelmében a nagy dielektromos állandójú oldószer csökkenti az ionok közti erőt. Mivel a keletkező hidratált ionok stabilabbak, mint a kristályrács, a szolvatáció energetikailag kedvezményezettebb.
Oldódás, felületaktivitás, H-híd kötések, hidrofób kötések, ionizáció, makromolekulák konformációja – mindezekhez köze van a víznek. A víznek nagy dipólusmomentuma és és dielektromos állandója van, és könnyen képez hidrogénhíd kötéseket. Ionos vegyületek igen jól oldódnak, mivel Coulumb törvénye értelmében a nagy dielektromos állandójú oldószer csökkenti az ionok közti erőt. Mivel a keletkező hidratált ionok stabilabbak, mint a kristályrács, a szolvatáció energetikailag kedvezményezettebb.
Oldékonyság
A szervezet mint biokémiai rendszer legnagyobb részét víz alkotja, ebben vannak oldva a kis molekulák és diszpergálva az óriásmolekulák. A sejtek, szövetekben azonban nemvizes képletek is vannak, mint a különböző membránok, ezek pedig lipid természetűek és a hidrofób, apoláros molekulákat oldják jól. A vízoldékonyságot a poláros és ionos, vagy a H-híd képzést elősegítendő, magános elektronpárral rendelkező csoportok segítik elő.
Kevés olyan példa van, ahol tisztán az egy fázisban való oldékonyság korrelál a biológiai hatással. Ilyen például a primer alifás alkoholok baktericid hatása. Az alkoholokra érzékeny Bacillus typhosus törzs esetén mindegyik alkohol hatásos, mivel a toxikus koncentrációk a telítési görbe alatt vannak. A kevésbé érzékeny Staphylicoccus aureus estén a nagyobb szénatom számú alkoholok nem hatnak jól, mert vízben nem érhető el velük a megfelelő koncentráció.

Az alifás aminoknál nincs oldódási probléma, azonban C12 táján csökken a baktericid hatás (cut-off pont). A hatáscsökkenés oka itt a micellaképződés fellépése, ami miatt a hatékony szabad molekulák koncentrációja lecsökken.
Megoszlási hányados
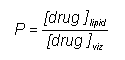 A megoszlási hányados a két fázis közötti egyensúlyi koncentrációhányadost jelenti. A szerkezet-hatás összefüggésekhez a gyakorlatban ezt a n-oktanol – víz (vagy pH 7,4-es puffer) közti klasszikus kirázásos módszerrel határozzák meg, vagy manapság fordított fázisú HPLC-vel. Ez utóbbi a P-vel arányos értékeket szolgáltat, bár a meglepetések miatt mindig a klasszikus módon is ellenőrizni kell néhány kapott értéket.
A megoszlási hányados a két fázis közötti egyensúlyi koncentrációhányadost jelenti. A szerkezet-hatás összefüggésekhez a gyakorlatban ezt a n-oktanol – víz (vagy pH 7,4-es puffer) közti klasszikus kirázásos módszerrel határozzák meg, vagy manapság fordított fázisú HPLC-vel. Ez utóbbi a P-vel arányos értékeket szolgáltat, bár a meglepetések miatt mindig a klasszikus módon is ellenőrizni kell néhány kapott értéket.
A megoszlási hányados erősen befolyásolja a transzport jelenségeket. Mivel az elsődleges szállító a vér, az innen való bejutást a további szervekbe nagyon befolyásolja, hogy az anyag hogy tud áthatolni a lipid barriereken. Például a vér-agy gáton (blood-brain barrier, BBB) csak a nagyon lipofil anyagok jutnak át. Mint az ábrán látható, nagyon kis lipofilitású (= hidrofil) anyagok nem jutnak be az agyba, mivel az egyetlen lehetséges mód a paracelluláris út, a sejtek közötti pórusok keresztüli diffúzió, ezekből pedig kevés van. Miután a lipofilitás elér egy küszöböt, a permeabilitás linárisan nő, majd egy platóba megy át, mivel az erősen lipofil anyagok a lipid környezetet kedvelik. Hogy a folyamat azért nem ilyen egyszerű, abból is látható, hogy a lipofilitás szempontjából nyilván egyforma D- és L-glukóz átjutása között egy nagyságrend különbség van. Ennek oka a szükséges anyagok aktív transzportjában rejlik, tehát a természetes D-glukózt ez a rendszer átszállítja az agy-vér gáton, de a természetellenes izomer nem szubsztrátja a transzportnak, így csak a passzív út marad. A peptidhormonok és egyéb messenger vegyületek is a transzportrendszer segítségére szorulnak.

Ha a metabolizmus során egy, a szervezet szempontjából exogén köztes anyag lipofilitása jelentősen megváltozik, komoly problémákat okozhat. Tankönyvi példa lehet erre a meperidin nevű kábító fájdalomcsillapító. Ez a többi hasonló szerhez hasonlóan szabadon nem kapható és világszerte a kábítószertörvény alá tartozik. Az illegális piacon ezért megjelent ennek egy hasonló hatású analógja (MPPP), amely az észter csoportot fordított helyzetben tartalmazza. Az ezt a szert élvezők között Kaliforniában feltünően gyakorivá vált egy egyébként igen ritka betegség, nevezetesen a gyorsan kialakuló fiatalkori Parkinson kór. Mint a hosszadalmas oknyomozás során kiderült, a reverz analóg molekula kémiailag kevésbé stabil és egy eliminációval keletkezett mellékterméket tartalmaz (MPTP) szennyeződés gyanánt, amely lipofil lévén szintén bejut az agyba. Itt az anyag a metabolizmus során egy aminoxidáz enzim (MAO B) hatására immónium származákká alakul, amely erős neuroméreg és azokat az idegsejteket károsítja, amelyek a természetes Parkinson-kór során is degenerálódnak. Mivel az immónium só már hidrofil sajátságú, nem tud átjutni vér-agy gáton és kiürülni, s feldúsulva kiváltja a toxikus tüneteket. Utóiratként a történethez tartozik, hogy az MPTP-t azóta a Parkinson-kór és egyéb idegsejt degeneratív betegségek kutatásában alkalmazzák.

A nagyon lipofil anyagok egyébként hosszú ideig lerakódhatnak a zsírszövetekben, ez speciális esetekben, pl. toxikus anyagok, gondot jelenthet (gondoljunk a korábban gátlástalanul alkalmazott rovarirtó DDT-re, amely igen zsíroldékony, ráadásul nehezen lebomló anyag, s az állatvilágot még ma is szennyezi).
Egyes nem specifikus kábítóhatású anyagok, pl. általános érzéstelenítők a víz-lipid megoszlási hányadossal arányosan hatnak. Az anesztéziára a szomatikus érzékelés hiánya jellemző, és sok anyaggal elő lehet idézni. A századfordulón Overton és Meyer állította fel a róluk elnevezett hipotézist, amely szerint:
- minden neutrális lipidoldékony anyag bénítja a neuronokat;
- a hatás a megoszlási hányadossal egyetemben növekszik.
Az alábbi táblázatban látható néhány anyag ebihalak mozgását gátló koncentrációja. A táblázatból kiviláglik, hogy bár egyre kisebb abszolut koncentráció szükséges a hatás kiváltásához, a lipid fázisban levő koncentráció a növekvő P miatt gyakorlatilag állandó, 20-50 mmol/L:
| Anyag | Oleilalkohol/víz megoszlási hányados |
Bénító koncentráció mol/l (víz) |
Számított bénító koncentráció mol/l (lipid) |
| etanol | 0.10 | 0.33 | 0.033 |
| n-butanol | 0.65 | 0.3 | 0.020 |
| valeramid | 0.30 | 0.07 | 0.021 |
| benzamid | 2.50 | 0.013 | 0.033 |
| szalicilamid | 5.90 | 0.0033 | 0.021 |
| o-nitro-anilin | 14.0 | 0.0025 | 0.035 |
| timol | 950.0 | 0.000047 | 0.045 |
Ezt az elképzelést Ferguson fejlesztette tovább 1939-ben, gázfázisú anyagokra bevezette a termodinamikai aktivitás fogalmát:

ahol pt az anyag parciális gőznyomása a narkotikus koncentrációnál, ps anyag telítési gőznyomása az adott hőmérsékleten. Oldatok esetén st a biológia hatáshoz szükséges moláris koncentráció, Ss az anyag moláris oldhatósága. A következő táblázatból látható, hogy értéke a különböző anyagoknál egy nagyságrenden belül van. Ez az összefüggés azonban csak a nemspecifikus hatóanyagokra érvényes. A strukturálisan specifikus hatású anyagoknál a hatás eléggé független a termodinamikai aktivitástól, és a kémiai szerkezet kis megváltoztatása is nagy hatásváltozással jár.
| Anyag | Letális toxikus koncentráció, 15°C, 100 perc (µmol/L) |
PS gőznyomás, 15°C, (mm) |
Pt/ PS toxikus koncentráció rel. gőznyomása |
| N-metil-anilin | 3.7 | 0.22 | 0.3 |
| N,N-Dimetil-anilin | 6.6 | 0.28 | 0.3 |
| Piridin | 76 | 10.4 | 0.1 |
| Bromoform | 94 | 3.2 | 0.5 |
| Tetraklóretán | 141 | 4.2 | 0.6 |
| Klórbenzol | 200 | 6.8 | 0.5 |
| Toluol | 420 | 17.0 | 0.4 |
| Benzol | 775 | 58 | 0.2 |
| Kloroform | 1040 | 128 | 0.2 |
| Széntetraklorid | 1600 | 73 | 0.4 |
| Hexán | 3000 | 96 | 0.6 |
| Pentán | 16600 | 320 | 0.9 |